Микробы ротовой полости, пробираясь в желудок и кишечник, могут провоцировать в них возникновение и рост злокачественных опухолей.
О бактериях в злокачественных опухолях известно довольно давно, но в последнее время интерес к ним заметно возрос: оказалось, что бактерии живут в очень многих, если не во всех, опухолях, и что их влияние на опухоль может быть двояким. Есть примеры, когда бактерии подавляют развитие опухоли, как в случае кожных микробов Staphylococcus epidermidis, мешающих размножаться злокачественным кожным клеткам. Но бывает и наоборот: два года назад мы писали, что бактерии опухолей рта и колоректальных опухолей прикрывают их от иммунной атаки, а сами опухоли под действием бактерий становятся более агрессивными. Обнаружили это сотрудники Онкологического исследовательского центра Фреда Хатчинсона, которые заодно определили, что агрессивности раку добавляют два рода микробов: бактерии Fusobacterium и бактерии Treponema.
В новой статье в Nature те же исследователи пишут уже о конкретном виде «злокачественной бактерии» – Fusobacterium nucleatum. Как известно, у разных видов бактерий может быть очень много штаммов, отличающихся друг от друга и генетически стабильных. У Fusobacterium nucleatum есть 80 штаммов, которые живут во рту (и их можно найти у людей, у которых нет никаких опухолей), и 55 штаммов, живущих в опухолях. Но пусть штамм живёт в опухоли, он ведь не обязательно ей помогает. Если опухолевая бактерия действительно опухолевая, то есть ей нравится жить именно в опухоли, а опухоль с ней только усиливается, тогда с появлением такой бактерии в опухоли её должно становиться особенно много.
У Fusobacterium nucleatum есть штамм, который особенно активно размножается в колоректальных опухолях – его назвали Fna. Однако в дальнейшем выяснилось, что штамм – это ещё не всё. Внутри Fna обнаружились две линии, которые раньше никак не различали – разница между ними обнаружилась только сейчас, когда Fusobacterium nucleatum начали пристально изучать на предмет её онкологической роли. Между обеими линиями Fna есть около двухсот генетических отличий. Молекулярно-генетические особенности раковой разновидности (которую назвали Fna C2), позволяют ей путешествовать из ротовой полости в толстую кишку и прямую кишку, не боясь кислотной среды желудка и пищеварительных ферментов. Как раз за счёт злокачественной разновидности и происходит увеличение численности Fusobacterium nucleatum в кишечнике пациентов с колоректальными опухолями. Когда Fna C2 подсаживали мышам, у мышей в кишечнике менялся обмен веществ в опухолевую сторону и появлялись аденомы – так называют доброкачественные опухоли, однако доброкачественная опухоль может стать злокачественной, и здесь главное, что бактерия стимулировала ненужное разрастание тканей.
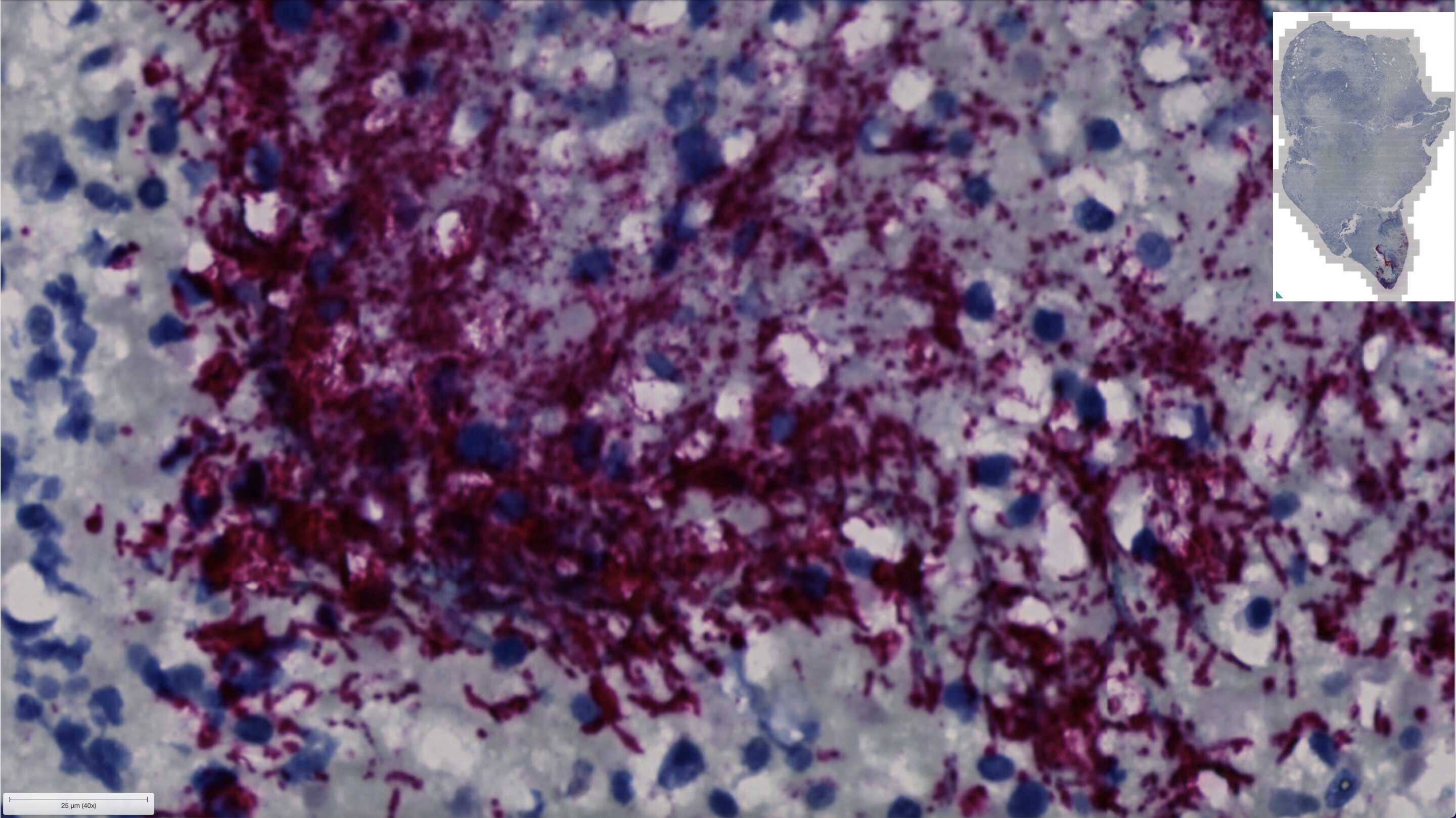
То есть, очевидно, Fna C2 действительно можно считать злокачественной бактерией – она не обязательно запускает рак, но она помогает ему развиваться. Уточнение портрета бактерии до штамма и даже до разновидности внутри штамма важно с клинической точки зрения. Если иметь в виду истребление опухолевых бактерий, нужно досконально знать их генетические особенности – потому что в их генах может крыться какая-нибудь устойчивость к лекарствам, характерная именно для этой разновидности и более ни для кого.
В другой недавней статье, опубликованной в Cell, речь идёт о раке желудка и бактерии Streptococcus anginosus. Вообще, когда говорят о раке желудка, обычно вспоминают Helicobacter pylori – довольно известную бактерию, которая может спровоцировать гастрит, язву и, в перспективе, рак. В то же время из всех людей, у которых есть Helicobacter pylori, рак желудка диагностируют только у 1–3%, а среди пациентов с хроническим гастритом у 20% нет никакой Helicobacter pylori. С другой стороны, у больных с желудочными опухолями в слизистой желудка увеличивается число Streptococcus anginosus (хотя обычно её обнаруживают в составе ротовой микрофлоры, вагинальной микрофлоры, в кишечнике, но не в желудке).
Эксперименты сотрудников Китайского университета Гонконга и Наньянского технологического университета говорят о том, что Streptococcus anginosus действительно может вносить свой вклад в развитие рака желудка. Во-первых, у мышей, которым в желудок подселяли Streptococcus anginosus, вскоре начиналось вялотекущее воспаление, длящееся вплоть до года. Сила воспаления была примерно такой же, как от Helicobacter pylori (если оба этих микроба оказывались в желудке одновременно, воспаление усиливалось вдвое). Желудочные клетки постоянно обновляются, в присутствии Streptococcus anginosus их в какой-то момент становилось больше чем нужно, и они входили в предраковое состояние. Одновременно Streptococcus anginosus влияла на состав микрофлоры: вслед за ней в желудке начинали селиться и другие бактерии, чьё обычное местообитание – ротовая полость; очевидно, изменения в микрофлоре тоже могут стимулировать опухолевые процессы. Наконец, Streptococcus anginosus усиливала рост уже имеющихся опухолей – это было показано в опытах, когда готовые микроопухоли из желудочных клеток пересаживали мышам под кожу или в слизистую желудка.
Исследователи также обнаружили у Streptococcus anginosus белок, с помощью которого она прикрепляется к клеткам слизистой желудка, чтобы потом проникнуть в них. Если бактерию лишали этого белка, её онкогенные свойства ощутимо слабели. Возможно, стоит подумать о лекарствах, которые были бы нацелены на Streptococcus anginosus и на её белок, который помогает ей взаимодействовать с клетками. Однако не стоит забывать, что все эти результаты были получены на мышах. Если желудочно-раковые свойства Streptococcus anginosus подтвердятся в клинических исследованиях, её можно будет считать по-настоящему «злокачественной бактерией», такой же, как разновидность Fna C2 у Fusobacterium nucleatum.
Автор: Кирилл Стасевич