Патогенные микробы часто умеют прятаться внутри наших клеток, где их не могут достать ни иммунитет, ни антибиотики. Конечно, сама заражённая клетка способна почувствовать, что в ней живёт кто-то неприятный, но и для этого случая у бактерий есть маскировочные фокусы.
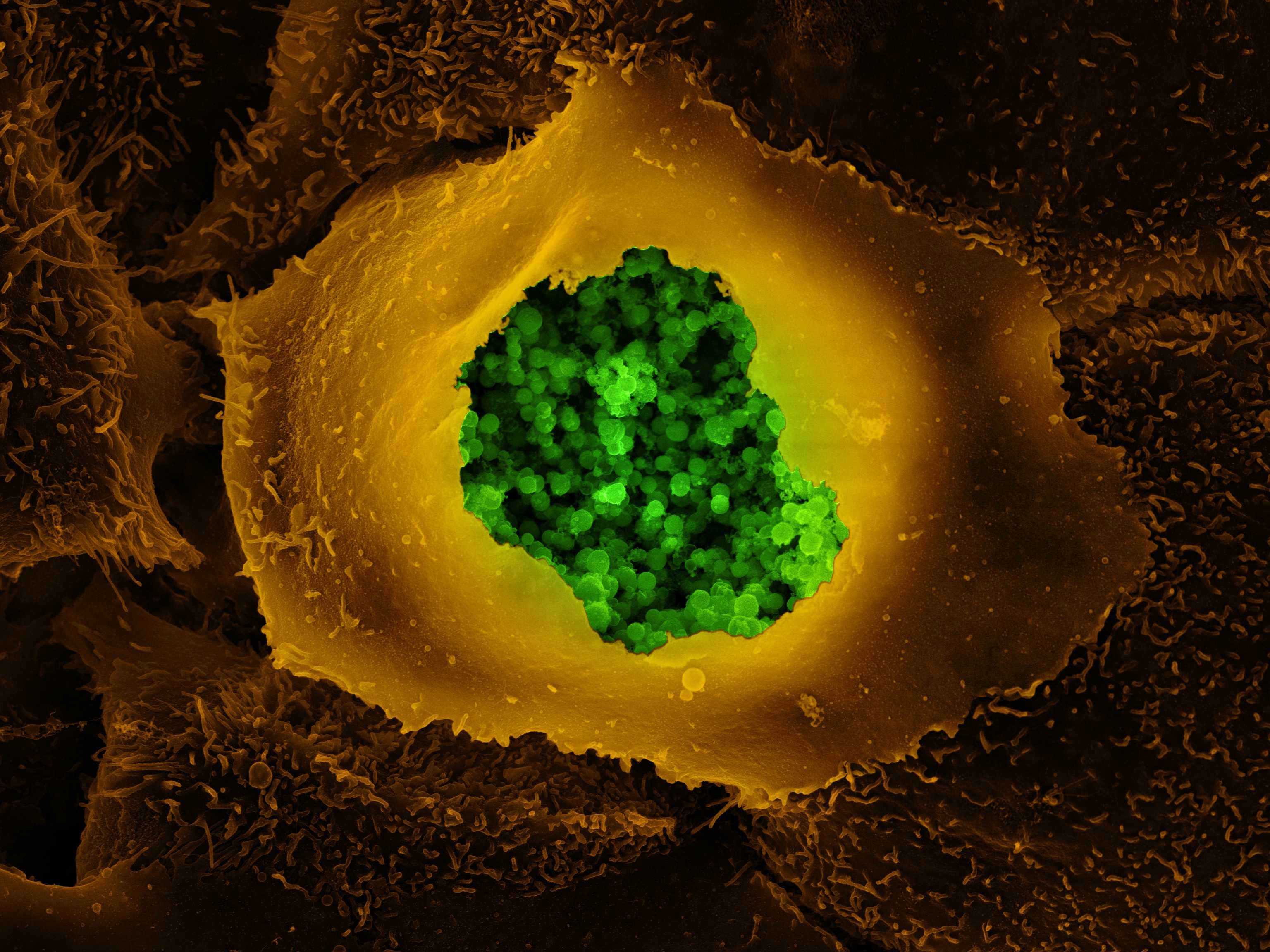
Например, так ведёт себя хламидия Chlamydia trachomatis, поражающая преимущественно мочеполовую систему. У хламидий есть несколько жизненных форм, которые меняются в зависимости от обстоятельств. Вне клетки они выглядят как мелкие сферические образования размером 0,2–0,4 микрометра с толстой клеточной стенкой — так называемые элементарные тельца. Внутри клетки элементарные тельца трансформируются в ретикулярные тельца, которые крупнее в несколько раз; хламидии в состоянии ретикулярных телец активно делятся и уязвимы для лекарств. Но если начать применять антибиотики, ретикулярные тельца хламидий превращаются в латентную форму — аберрантные тельца. В таком виде обмен веществ у них находится на минимуме, и потому антибиотики не могут им повредить.
Но антибиотик не единственное, что может испортить жизнь бактериям. Есть вещества, которым всё равно, идёт ли обмен веществ в клетке или нет. Например, соединения, генерирующие много активных форм кислорода — сильных окислителей, которые будут повреждать бактериальные молекулы вне зависимости от того, в какой форме находится бактерия.
Сотрудники Московского физико-технического института (МФТИ) вместе с коллегами из Центрального НИИ туберкулёза и других научных центров России и Франции в качестве антибактериального агента использовали краситель метиленовый синий. Если облучить его светом определённой длины волны, метиленовый синий простимулирует окислительный стресс для бактерии; произойдёт то, что называется фотодинамической инактивацией патогена.
Однако лекарство нужно доставить внутрь клетки, причём оно должно не просто пройти через наружную клеточную мембрану, но и найти внутри клетки путь до бактерии, и ещё удержаться внутри клетки достаточно долго, чтобы успеть подействовать. Для доставки метиленового синего использовали металл-органические каркасные наночастицы: в них атомы металла (или кластеры атомов) соединены органическими перемычками; в отверстия образовавшейся пространственной решётки помещают нужные молекулы. В данном случае наночастицы были сделаны из железа и тримезиновой кислоты; такие частицы малотоксичны, стабильны в воде и биоразложимы, и самое главное, их готовы поглощать живые клетки. Эксперименты ставили с иммунными макрофагами, в которых «спящие» хламидии образовывали скопления-включения. Наночастицы концентрировались именно в хламидийных включениях, так что те кислородные радикалы, которые появлялись благодаря лекарству, действовали только на бактерий. (Радикалы долго не живут, и потому у них не было никакого шанса уйти от бактерий, скопившихся в цитоплазме, и добраться, например, до клеточного ядра с хромосомами.)
В статье в ACS Infectious Diseases говорится, что в заражённых макрофагах все бактерии после появления наночастиц инактивировались, причём железо, входящее в каркас частиц, ещё сильнее стимулировало появлении радикалов-окислителей. Незаражённым клеткам наночастицы никак не вредили. В перспективе такой метод может помочь в борьбе с латентными инфекциями, причём не только хламидийными: в латентной форме в клетках может жить туберкулёзная Mycobacterium tuberculosis и Listeria monocytogenes, вызывающие листериоз.