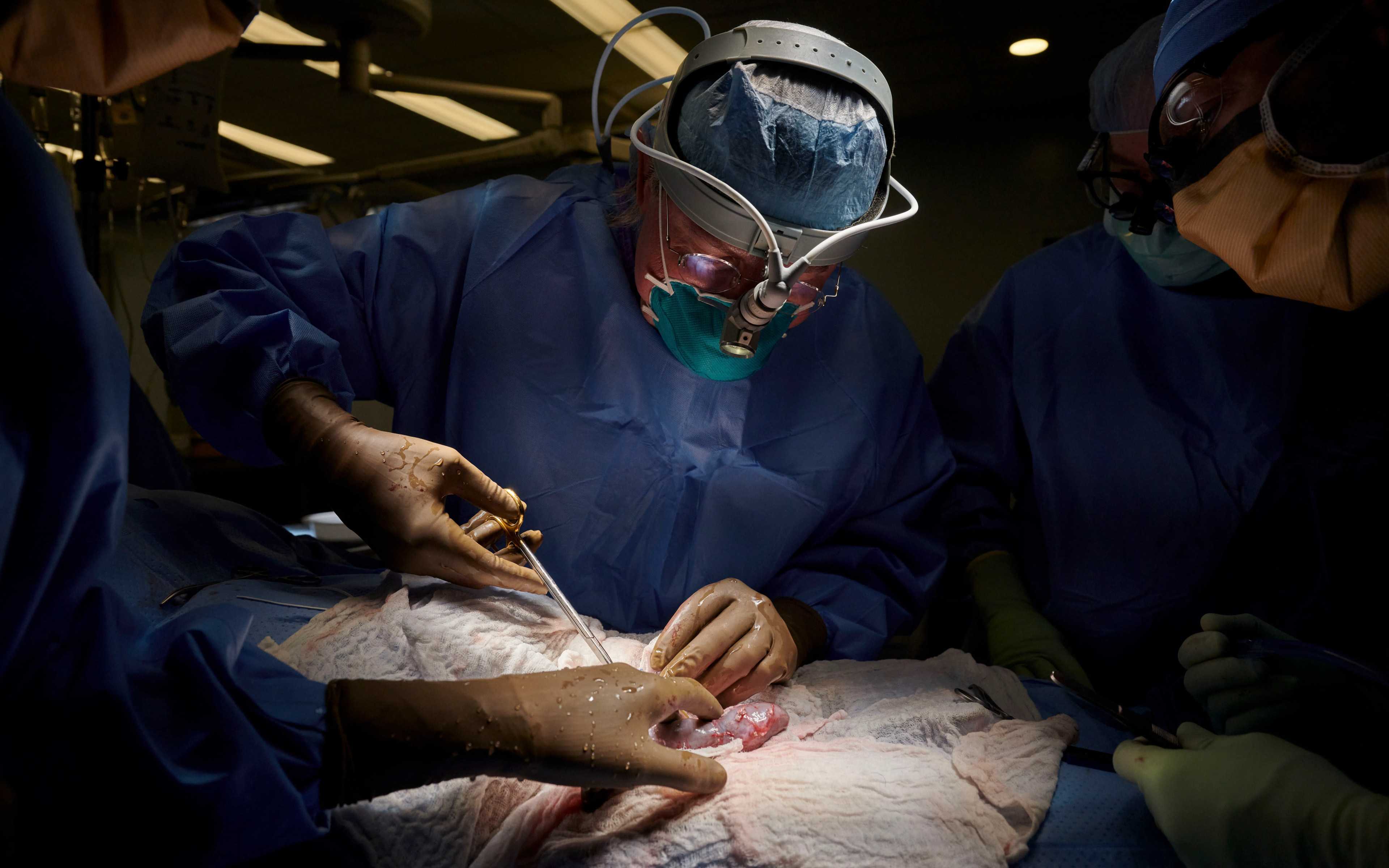
57-летний мужчина из Мэриленда уже больше трёх недель живёт с пересаженным сердцем генетически модифицированной свиньи. Его врач назвал операцию «прорывным хирургическим вмешательством», которое может помочь решить кризис нехватки органов. Но, с научной точки зрения, ещё слишком рано судить о том, насколько далеко это продвинет дело.
Использование органов животных для лечения людей — идея с долгой, драматичной и часто разочаровывающей историей. По словам Джо Левенталя (Joe Leventhal), хирурга, возглавляющего программу трансплантации почек в Медицинской школе Файнберга Северо-Западного университета (Northwestern University Feinberg School of Medicine) в Чикаго, о ксенотрансплантации, так называется эта перспективная отрасль медицины, существует старая поговорка: «Она буквально за углом. Проблема в том, что это очень, очень, очень далёкий угол».
Но серия новых экспериментов, в том числе три опыта с пересадкой свиных почек людям, которых временно поддерживают на аппаратах искусственной вентиляции лёгких, предоставили обнадёживающие доказательства того, что наконец-то стало возможным достичь цели, к которой стремились на протяжении десятилетий.
Последние операции на людях были проведены после масштабных испытаний по созданию генетически изменённых органов свиней, которые не подвергались бы резкому отторжению, наряду с дальнейшим совершенствованием препаратов, подавляющих иммунную систему и повышающих приживаемость этих органов. Тем не менее, операция на сердце в Мэриленде была отчаянной попыткой спасения жизни, а не частью клинических испытаний, — тщательно разработанного исследования, которое в конечном итоге необходимо для того, чтобы показать, могут ли органы свиней функционировать у людей, причём безопасно.
Один случай может дать ценную информацию о том, как организм реагирует на орган, говорит Карен Машке ( Karen Maschke), учёная-специалистка по биоэтике из Центра Гастингса (Hastings Center) в Гаррисоне, штат Нью-Йорк, редакторка журнала Ethics & Human Research.
«Вы можете найти то, что не ожидали найти», — говорит она.
Но один фрагмент данных не имеет необходимого для выводов контекста, особенно если речь идёт о тяжелобольном пациенте и совершенно новой технологии. Без исследования, сравнивающего несколько тщательно отобранных пациентов, трудно понять, является ли опыт одного человека типичным.
Тем не менее, последняя волна экспериментов по пересадке органов от свиньи к человеку может помочь раскрыть потенциал клинических испытаний, которые нужны исследователям. Это единственный способ значительно продвинуть науку, говорит кардиохирург Дэвид Купер (David Cooper) из Массачусетской больницы общего профиля (Massachusetts General Hospital) в Бостоне, который давно изучает идею ксенотрансплантации.
Свиные надежды
Если клинические испытания в конечном итоге окажутся успешными, животные могут помочь облегчить острую нехватку донорских органов. В одних только США из 106.000 человек, ожидающих пересадки органов, около 90.000 нуждаются в почке. Многие из них умрут, так и не дождавшись пересадки.
Врачи уже обращались к органам животных в смелых, привлекающих внимание начинаниях. Известный хьюстонский кардиохирург Дентон Кули (Denton Cooley) в 1960-х годах пересадил сердце овцы в отчаянном стремлении спасти умирающего человека; организм мужчины быстро отторг орган.
Одна из самых громких операций по ксенотрансплантации произошла в 1984 году, когда врачи из Медицинского центра университета Лома Линда (Loma Linda University Medical Center in California) в Калифорнии пересадили сердце бабуина двухнедельному ребенку, родившемуся со смертельным пороком сердца. Малышка Фейри, как ее называли, прожила 21 день, и её операция стала причиной многих споров. Некоторые специалисты по медицинской этике назвали операцию «зверским делом», которому не хватает моральной чистоты. Учёные же «поспешно ретировались обратно в лабораторию», говорится в отчёте, опубликованном в 1995 году в Journal of the American Medical Association.
В последнее время учёные сосредоточились на свиньях, в основном потому, что органы свиней примерно такого же размера, как у взрослых людей, и эти животные уже выращиваются в промышленных масштабах. Тем не менее, осуществимость этой идеи была поставлена под сомнение после того, как в 1980-х годах было обнаружено, что клетки свиней покрыты дисахаридом, известным как альфа-гал (галактоза-альфа-1,3-галактоза), который вызывает сильную реакцию иммунной системы человека.
В 1990-х годах в развитии этой области также произошел сбой, когда выяснилось, что геном свиней содержит встроенные вирусы — фрагменты вирусного генетического кода, вплетённые в генетические инструкции свиней. (Это не только свиная особенность; подобные вирусные гены составляют примерно 8 процентов генома человека). Эти вирусы, называемые эндогенными ретровирусами свиней, не беспокоят свиней, но могут вызвать проблемы, внезапно оказавшись в организме другого вида.
В начале 2000-х годов исследователи сообщили о создании генетически модифицированных свиней, лишенных альфа-гала, что теоретически делало их более совместимыми с иммунной системой человека, чем свиньи прямо с фермы. Это сообщение положило начало попыткам разведения животных без альфа-гала, в первую очередь в США, компанией Revivicor, принадлежащей United Therapeutics, расположенной в Блэксбурге, штат Вирджиния. Затем, в 2020 году, гигантский скачок на пути к возможности трансплантации органов от свиней человеку был сделан, когда Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) США впервые одобрило свиней Revivicor для использования в медицине.
Ксенотрансплантация также получила толчок в виде технологии редактирования генов CRISPR/Cas9 с её замечательной способностью «вырезать» гены по усмотрению исследователей. Используя CRISPR, учёные могут удалять нежелательные вирусные гены у свиней.
В недавних экспериментах свиные почки и сердца были успешно пересажены бабуинам. Хотя при первых попытках ксенотрансплантации бабуины умирали в течение нескольких дней, в 2018 году исследователи сообщили, что пересаженные свиные сердца продолжали биться в груди двух бабуинов в течение примерно шести месяцев, что на тот момент было рекордом. Другие аналогичные эксперименты повторили этот срок выживания.
Затем, в октябре 2021 года, ученые из Langone Health в Нью-Йорке совершили переход к людям: в ходе испытаний они пересадили почку Revivicor человеку с клинической смертью мозга и наблюдали за работой органа в течение 54 часов — предположительно достаточно долго, чтобы обнаружить признаки немедленного отторжения. Менее чем через два месяца та же команда хирургов повторила эксперимент. Третья подобная трансплантация, проведённая исследователями из Университета Алабамы (University of Alabama) в Бирмингеме, на этот раз в брюшную полость человека, которому после аварии на мотоцикле временно поддерживали жизнь с помощью аппарата искусственной вентиляции лёгких, была описана 20 января в American Journal of Transplantation.
Ни одна из почек, пересаженных людям, не вызвала немедленного иммунного отторжения, и органы даже начали вырабатывать мочу, сообщили врачи. Учитывая подавляющую потребность в почках и уже проведённые пробные операции, большинство экспертов предсказывали, что первому современному пациенту, получившему ксенотрансплантат, понадобится именно почка.
Затем пришло неожиданное известие о Дэвиде Беннете.
Я хочу жить
Беннетт страдал от острой сердечной недостаточности и не подходил для пересадки человеческого сердца. В канун Нового года FDA дало врачам из Медицинского центра Университета Мэриленда (University of Maryland Medical Center) разрешение на пересадку свиного сердца по специальному протоколу, который иногда называют сострадательным использованием («compassionate use») и который позволяет очень больным людям получить срочный доступ к экспериментальным препаратам или устройствам — даже тогда, когда пациент, например, не подходит для какого-либо исследования препаратов, или тогда, когда подходящего исследования не существует. Новое сердце Беннетта было получено от генномодифицированной свиньи Revivicor.
В заявлении, опубликованном больницей, Беннетт сказал, что согласился на экспериментальную операцию, потому что у него просто не было вариантов. Он был прикован к постели, и ни одна больница не предложила бы ему пересадку сердца, хотя бы отчасти потому, что он в прошлом не следовал рекомендациям врачей. «Либо умереть, либо сделать эту пересадку, — сказал он. — Я хочу жить». Восьмичасовая операция была проведена 7 января.
Чуть больше трёх недель спустя Беннетт продолжает поправляться, говорит Мухаммад Мохиуддин (Muhammad Mohiuddin), хирург, который руководит программой ксенотрансплантации сердца в больнице и входил в состав бригады, проводившей операцию. Повседневные достижения, такие как разговор с персоналом о футболе, — это крошечные победы.
«Мы считаем все эти маленькие победы и надеемся, что это сердце будет поддерживать его и дальше. Сердце настолько сильное, что врачам пришлось уменьшить его мощность, потому что оно оказалось слишком мощным для организма Беннета, ослабленного неделями лежания в постели. Мы поставили двигатель новенького Ferrari в машину 1960 года»,
Тем не менее, Купер из Массачусетской больницы сказал, что был удивлен, когда узнал, что первый живой пациент, получивший свиной орган, получил сердце, а не почку.
«Что они будут делать, если этот трансплантат постепенно начнёт отказывать? — спрашивает он. — Я думал, что сначала будет почка. Потому что если она откажет — скажем, произойдёт отторжение, которого вы не ожидали, или возникнет инфекция, с которой вы не сможете справиться, — вы сможете удалить почку, прекратить всю иммуносупрессивную терапию и вернуть пациента на диализ».
Пересадка сердца не так обратима.
Купер и хирург Хидетака Хара (Hidetaka Hara), которые вместе работали в Университете Алабамы (University of Alabama at Birmingham), предлагали, чтобы первая ксенотрансплантация была поэтапным клиническим испытанием с четырьмя пациентами, ожидающими почку. Испытание должно проходить следующим образом: через три месяца после пересадки органа первому пациенту, если у него не будет осложнений, провести операцию со вторым. Если у этих двоих всё хорошо, через три месяца пересаживают третью свиную почку, а через три месяца после этого — четвёртую. Исследователи предлагали этот протокол в сентябре в журнале EBioMedicine.
По словам Купера, начинать клинические испытания с почек имеет смысл ещё и потому, что потребность в них гораздо выше. Около 83 процентов в листе ожидания трансплантации составляют люди, которым нужны почки; в сердце нуждаются 3 процента.
Именно поэтому компания eGenesis, расположенная в Кембридже, штат Массачусетс, сосредоточила исследовательские усилия на почках. Майк Кёртис (Mike Curtis), президент компании по исследованиям и развитию, говорит: «Это то место, где потребность доминирует». eGenesis, которая занимается разведением свиней с генной модификацией и иммунной совместимостью, надеется начать клинические испытания на шести-десяти пациентах с пересаженными свиными почками примерно в 2024 году.
Мохиуддин говорит, что причина, по которой он провёл операцию на сердце, проста: он кардиохирург, а пациент был при смерти. «Мой 30-летний интерес был связан только с сердцами», — говорит он. По его словам, его исследовательская группа обратилась в FDA за разрешением на проведение клинических испытаний, но агентство хочет сначала получить более полные данные исследований на бабуинах.
Ещё не всё
Если Беннетт выпишется из больницы и отправится домой, это громкое событие может послужить не только тому, чтобы он мог больше времени проводить со своей семьёй: по словам Купера, это может помочь убедить FDA дать добро на проведение более масштабного, научно обоснованного испытания.
Если Беннетт и дальше будет чувствовать себя хорошо, то врачи «смогут в течение следующих нескольких месяцев провести исследование на нескольких пациентах [с сердцем]. А затем они вернутся в FDA и скажут: «Смотрите, эти пациенты в целом справились. Теперь мы можем провести соответствующую серию, где возьмём пациентов из нашего собственного листа ожидания и проведём трансплантацию?»
Левенталь возлагает такие же надежды на одобренные клинические испытания:
«Единственный способ увидеть, обеспечивают ли эти органы значимую функцию в долгосрочной перспективе у людей так, чтобы оправдать их использование, — это пересадить их людям и понаблюдать за ними достаточно долго».
Тем не менее, пока неясно, будет ли это происходить в рамках сострадательного использования, как это сделали с Беннеттом, или в рамках официальных исследований. Положение FDA о расширенном доступе было разработано для того, чтобы помочь людям получить лекарства и процедуры, которые они не могли бы получить на обычных условиях.
«Должен ли он [расширенный доступ] был использоваться в случае с органом — это интересный этический, нормативный и политический вопрос»,
«Одна из проблем, связанных с тем, что они пошли по этому пути, заключается в том, что в стране, вероятно, есть сотни пациентов с сердечными заболеваниями, которые не стоят в листе ожидания, потому что слишком больны. Некоторые из них могут сказать: „Я никогда не соглашусь орган животного“. Но некоторые могут сказать: „Да, я бы взял свиное сердце. Я тоже хочу это сделать. Вы можете обеспечить мне доступ?“»
Но открытие этих возможностей может усложнить поиск добровольцев для клинических исследований. А в некоторых случаях это может привести к обратному результату. Именно это произошло в 1990-х годах, когда врачи начали предлагать женщинам с запущенным раком молочной железы огромные дозы химиотерапии с последующей трансплантацией костного мозга для восстановления разрушенной иммунной системы. Тысячи женщин получали экспериментальное лечение в рамках расширенного доступа — так много, что учёным было трудно найти участниц для исследований. И когда научные испытания были, наконец, проведены, лечение не показало никакой эффективности.
Вот почему часто возникает опасение, что не нужно двигаться слишком быстро, «потому что мы не хотим пустить науку под откос, наука развивается постепенно», — считает Машке.
На данный момент трансплантация от свиньи к человеку имеет логистические проблемы, которые будут ограничивать её использование. Во-первых, таких свиней трудно раздобыть. Помимо редкой генетической родословной, их необходимо выращивать в стерильных условиях, чтобы они не заразились микробами, которые могут передаться человеку. Ещё одно возможное препятствие: группы по защите прав животных осудили идею использования свиней в качестве запасных частей для людей как «жестокую и опасную», и обществу придётся как-то примирить эту позицию с насущной медицинской необходимостью.
Но сначала врачам нужно узнать, возможна ли вообще ксенотрансплантация, или всё снова закончится неудачей.
«Мы не знаем, — рассуждает Левенталь, — как долго и насколько хорошо эти органы будут работать у пациентов. Единственный способ оценить это — пересадить их».
Автор: Лора Бейл (Laura Beil), Перевод: Мария Толмачёва