При помощи биспецифичных антител ученым удалось уничтожить раковые клетки с самой распространенной мутацией в p53, которые особенно плохо распознаются иммунной системой.
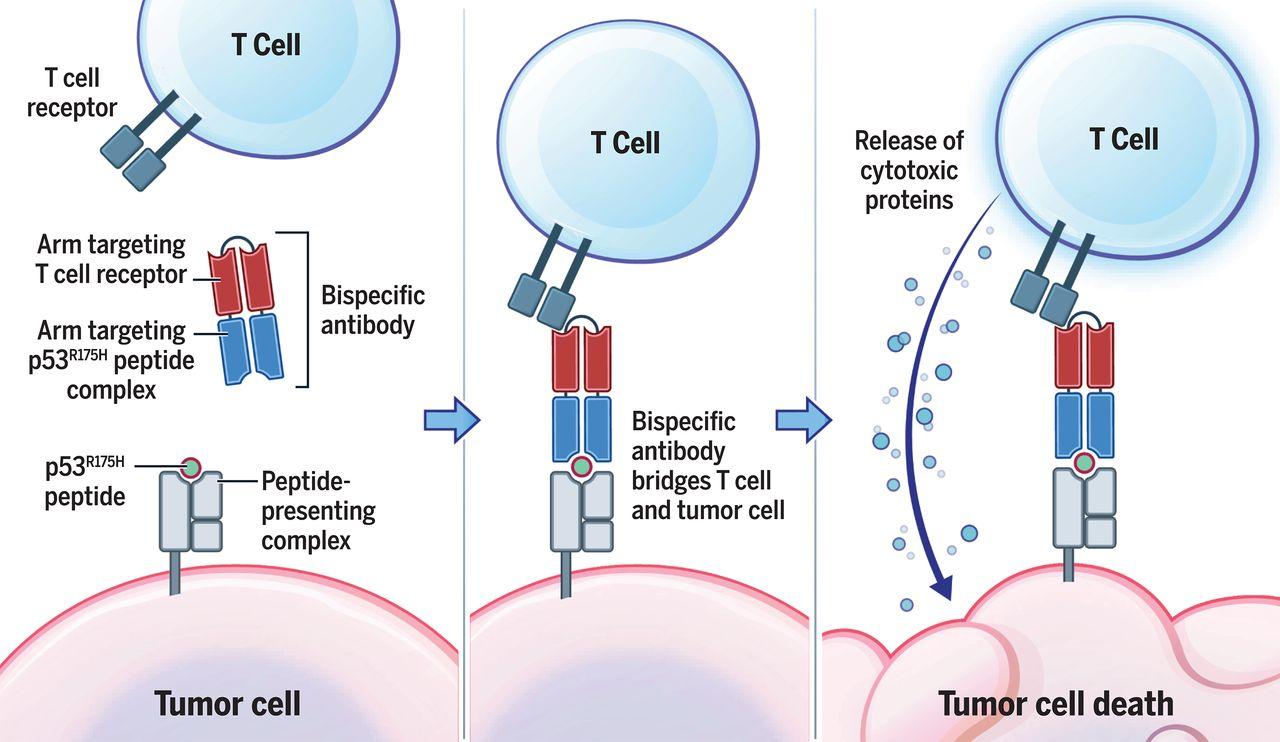
Несмотря на то, что на поверхности раковых клеток оказывается очень мало комплексов ГКГС с мутировавшим участком белка биспецифичные антитела успешно находят их in vitro и in vivo на мышах и активируют Т-клетки для их уничтожения. В теории этот подход, опубликованный в журнале Science, может пригодиться при терапии и других видов рака со сложными мутациями.
Мутаций, способных запустить процесс превращения клетки в злокачественную опухоль очень много. Часто они меняют работу генов регулирующих клеточное деление и аккуратность копирования ДНК, причем это могут быть как гены-онкосупрессоры, так и протоонкогены. В случае протоонкогенов их активность возрастает, они становятся заметнее для организма и могут использоваться в качестве мишеней для иммунотерапии. Онкосупрессоры же присутствуют в клетке на низком уровне и специфичным для этой мутации Т-клеткам, — основным борцам с раком — их сложно найти.
Повысить внимательность Т-клеток можно разными способами, один из которых — биспецифичные антитела. Это синтетические антитела, которые способны узнавать сразу два разных антигена и приклеиваться к ним. Идея заключается в том, чтобы антитело, узнающее одновременно Т-клетки и неправильный кусочек иммуносупрессора, склеивало больную и иммунную клетки, запуская механизм активации последней. До сегодняшнего дня на основе биспецифичных антител сделали несколько дорогих противораковых лекарств и попробовали применить их в борьбе с ВИЧ.
Эмили Хань-Чжун Сюэ (Emily Han-Chung Hsiue) и ее коллеги из Университета Джонса Хопкинса применили эту технологию для поимки сломанного белка p53, — основного регулятора клеточного цикла клеток. Они создали антитела, которые должны узнавать вариант этого белка с самой распространенной мутацией (R175H), а нормальный вариант белка не трогать. Вторая мишень этих антител — цитотоксичные Т-клетки. Связь с ними включает иммунный ответ, Т-клетки выделяют гранзимы и перфорины и от их воздействия раковая клетка погибает. В случае, если антитело перепутает здоровую клетку с больной, иммунитет ополчится против организма, поэтому точность узнавания антителом ракового антигена играет очень важную роль.
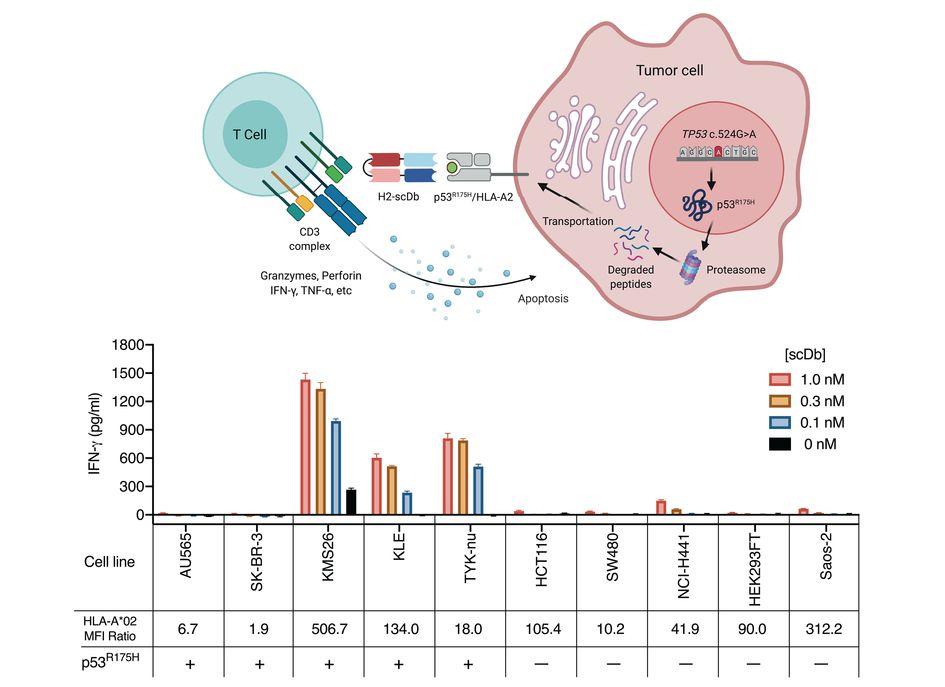
Участки белка p53 по которым различаются здоровые и больные клетки могут демонстрироваться раковой клеткой на рецепторах ГКГС, где их могут увидеть иммунные клетки. Ученые подобрали два варианта антител, способных узнать этот комплекс. Специфичность узнавания у одного из антител была ниже, — оно иногда путало здоровый и мутантный варианты, так что для дальнейшего анализа был выбран другой, более точный вариант.
Совместная культивация Т-клеток с клетками четырех раковых линий с нужной мутацией показала, что действительно в присутствии биспецифичных антител Т-клетки проявляют цитотоксичность и уничтожают раковые клетки, причем это происходит даже в том случае, когда мутантного белка очень мало.
Тестирование in vivo также дало обнадеживающие результаты: у мышей, которым подсадили человеческие клетки миеломы биспецифичные антитела стимулировали эффективную работу Т-киллеров против клеток с мутантным p53, что в целом привело к уменьшению опухолей.
У биспецифичных антител есть свои сильные и слабые стороны. В отличие от CAR-T лимфоцитов — аналогичного широко известного варианта иммуннотерапии — они универсальны и не изготавливаются заново под каждого пациента. В то же время эти антитела не умеют самовоспроизводиться в организме и на протяжении всего курса требуется пополнять их запас извне. Как и в случае CAR-T терапия биспецифичными антителами может привести к цитокиновому шторму, но — судя по результатам недавних работ — этого можно избежать заблокировав выброс одного из цитокинов.
Автор: Вера Мухина