Американские исследователи применили алгоритмы машинного обучения для создания модели, которая определяет старение 11 ключевых органов по характерным для них белкам в плазме крови.
С ее помощью они установили, что примерно у 20 процентов населения резко укорено старение одного из органов, а у 1,7 процента — сразу многих. Также авторы проследили связь старения отдельных органов с разными заболеваниями, такими как сердечная недостаточность и болезнь Альцгеймера. Публикация об этом появилась в журнале Nature.
Поиск молекулярных биомаркеров старения играет ключевую роль в разработке лекарств и других методов борьбы с возрастными изменениями. К настоящему времени разработано несколько подходов к оценке биологического возраста организма в целом — известным примером могут служить эпигенетические часы Стива Хорвата. При этом старение органов и систем происходит неравномерно, и траектории старения у разных людей значительно различаются. В силу этого возникает необходимость оценивать старение отдельных органов, чтобы понять его связь с заболеваниями и персонализировать возможные методы профилактики и лечения. Однако существующие экспериментальные методики применимы не ко всем органам и зачастую дорогостоящи и инвазивны.
Тони Уисс-Корэй (Tony Wyss-Coray) из Стэнфордского университета с коллегами из разных научных центров США количественно проанализировали 4979 белков плазмы крови у 5676 человек из пяти независимых когорт (Covance, LonGenity, SAMS, Stanford-ADRC, Knight-ADRC) и картировали предполагаемый орган-специфичный плазменный протеом, используя данные полного секвенирования РНК человеческих органов из проекта Genotype-Tissue Expression (GTEx). Гены считали обогащенными в органах, если уровень их экспрессии в одном органе был как минимум вчетверо выше, чем в любом другом, как следует из определения ресурса Human Protein Atlas. Всего этому определению соответствовали 893 (18 процентов) из рассматриваемых белков, больше всего из них относилось к мозгу. После контроля качества данных для анализа были отобраны 856 (17,9 процента) из 4778 белков плазмы.
Полученные данные использовали для обучения моделей старения на основе оператора LASSO для 11 важных в плане развития возрастных заболеваний органов: головного мозга, сердца, артерий, легких, кишечника, печени, поджелудочной железы, почек, иммунной ткани, мышц и жировой ткани. Для сравнения также обучили модели старения организма в целом с использованием 3907 орган-неспецифичных белков и плазменного протеома в целом с использованием всех 4778 белков. Все полученные модели обучили на 1398 здоровых участниках когорты Knight-ADRC (возраст 27–104 года, в среднем 75 лет), после чего проверили их на пациентах с деменцией из Knight-ADRC и участниках из всех остальных когорт. После множественных коррекций теста оценку старения во всех когортах признали адекватной.
У участников с одинаковым несовпадением возраста плазмы в целом с биологическим возрастом наблюдались разные профили старения отдельных органов. На популяционном уровне возрастные несоответствия отдельных органов слабо или умеренно коррелировали друг с другом, но сильно — со старением плазмы и организма в целом. У некоторых индивидов старение одного или нескольких органов было крайне выраженным по сравнению с общепопуляционным — исследователи использовали отсечку в два стандартных отклонения и кластеризовали таких людей по экстремальным типам старения (extreme aging types, e-ageotypes, «э-эйджиотипам»). Контринтуитивно оказалось, что такие типы для разных органов относительно редко встречаются вместе: экстремальное старение какого-либо одного органа наблюдалось у 18,4 процента индивидов, в то время как нескольких — лишь у 1,7 процента. Единственный мультиорганный э-эйджиотип, выявленный путем несмещенной кластеризации, характеризовался крайними возрастными несоответствиями мозга, сердца, печени, иммунитета, жировой ткани, плазмы и организма в целом. Таким образом, биологический возраст отдельных органов может давать уникальную информацию о старении и возрастных заболеваниях.
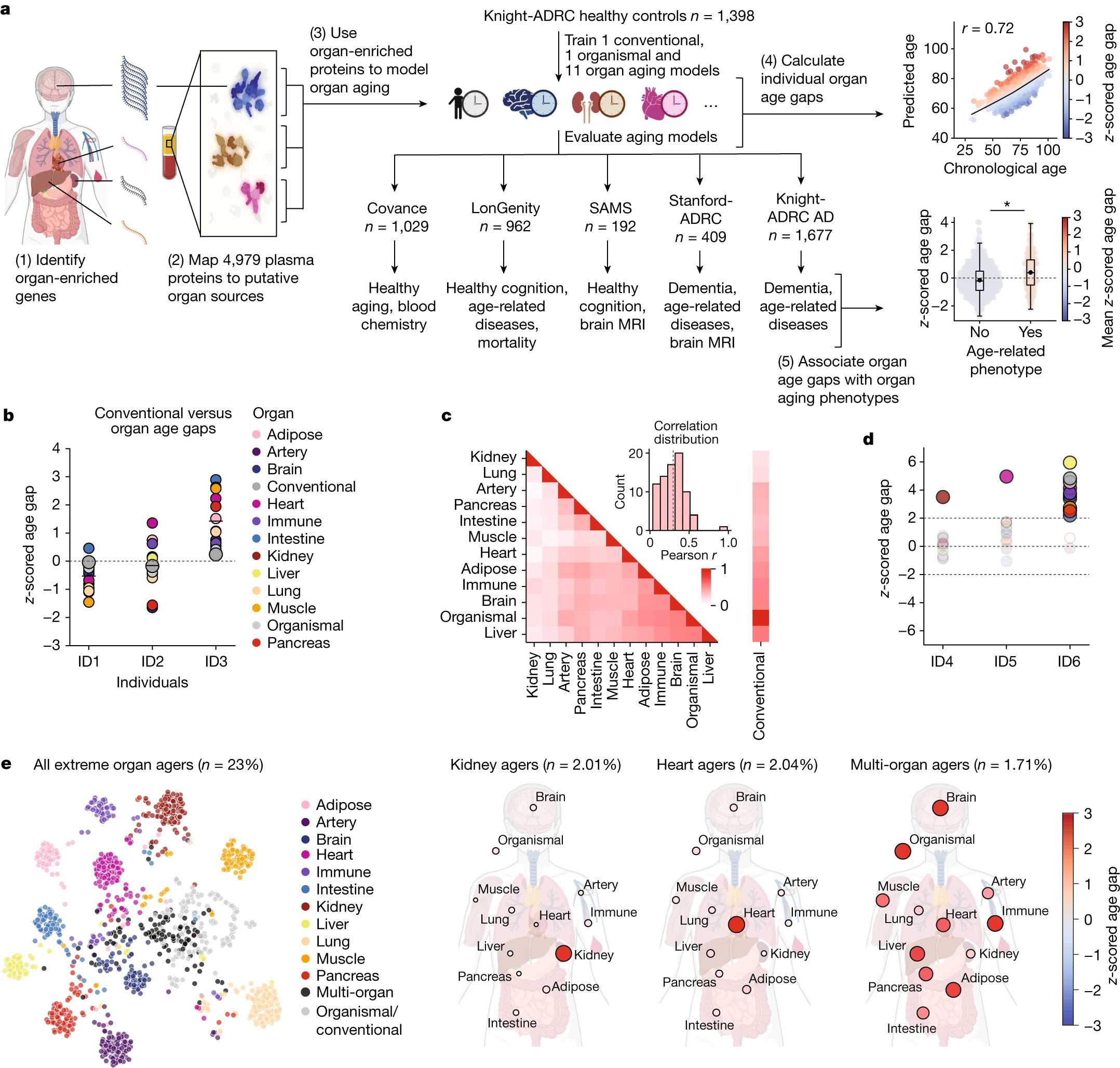
Дальнейший анализ моделей и сведений о здоровье участников показал, что экстремальные типы старения связаны с соответствующими заболеваниями и состояниями: почечный — с метаболическими (сахарный диабет, ожирение, гиперхолестеринемия и гипертензия); сердечный — с сердечными (мерцательная аритмия и инфаркт миокарда); мышечный — с нарушениями осанки; мозговой — с цереброваскулярными заболеваниями; организма в целом — с болезнью Альцгеймера. На популяционном уровне наиболее статистически значимые связи наблюдались для почек — при гипертонии они были биологически в среднем на год старше, чем у остальных сверстников, при диабете — на 1,3 года. Следующим шло сердце — при мерцательной аритмии его биологический возраст был в среднем больше на 2,8 года; при инфаркте — на 2,6 года.
Кроме того, исследователи разработали отдельный алгоритм для преобразования признаков с целью дать балльную оценку важности каждого белка для хронологического и биологического возраста. Он получил название FIBA (feature importance for biological aging, важность признаков для биологического старения). С его помощью они смогли охарактеризовать связь экстремального старения мозга и — отдельно — совокупности остальных органов с когнитивным снижением и деменцией, в том числе на уровне отдельных клеточных и молекулярных процессов. Оказалось, что таким способом можно предсказать прогрессирование болезни Альцгеймера не менее точно, чем по уровню фосфорилированного тау-белка в крови, который в настоящее время считается наилучшим биомаркером этого заболевания.
Таким образом, моделирование с использованием машинного обучения может стать простым и интерпретируемым методом для изучения старения органов по протеомному профилю плазмы, а также предсказания риска заболеваний, заключают исследователи.
Автор: Олег Лищук