Американские и швейцарские исследователи обнаружили, что долгосрочное репрограммирование клеток в организме мышей приводит к печеночной и кишечной дисфункции, потере массы тела и быстрой смерти.
У трансгенных животных, не экспрессирующих факторы Яманаки в печени и кишечнике, удалось избежать подобной ранней летальности и пронаблюдать у них признаки снижения биологического возраста. Такие мыши могут помочь в дальнейшем изучении регенерации тканей, омоложения организма и побочных эффектов при репрограммировании клеток in vivo. Отчет о работе опубликован в журнале Nature Aging.
Индукцию экспрессии факторов транскрипции Oct4, Sox2, Klf4 и c-Myc (OSKM, или факторов Яманаки) в зрелых соматических клетках широко используют для их репрограммирования в индуцированные плюрипотентные стволовые клетки (ИПСК) in vitro. В 2013 году исследователи под руководством испанца Мануэля Серрано (Manuel Serrano) впервые попытались запустить экспрессию этих факторов у живых мышей. В теле животных появились стволовые клетки, подобные эмбриональным, но по всему организму у них начали расти раковые опухоли и тератомы, и они быстро умирали. Тремя годами позже группа ученых, возглавляемая Хуаном Карлосом Исписуа Бельмонте (Juan Carlos Izpisua Belmonte) из Института Солка, смогла продлить жизнь мышам с искусственно ускоренным старением (моделью прогерии), включая OSKM не постоянно, а циклически. В январе 2023 года команда Ноя Дэвидсона (Noah Davidsohn) из компании Rejuvenate Bio сообщила об успешном применении репрограммирования клеток для укрепления здоровья и продления жизни обычным, но очень старым мышам. При этом механизмы такого многообразного действия OSKM и побочных эффектов их экспрессии изучены недостаточно.
Чтобы разобраться в них, Алехандро Окампо (Alejandro Ocampo), работавший в группе Бельмонте, с коллегами из Лозаннского и Калифорнийского университетов, компаний EPITERNA SA и Altos Labs выполнили сравнительные анализ двух наиболее изученных линий трансгенных мышей, у которых можно искусственно запускать репрограммирование клеток: 4Fj (экспрессируются OSKM кроме c-Myc) и 4Fs-B (экспрессируются все OSKM). При индукции экспрессии трансгенов в двухмесячном возрасте животные в обеих группах, как и ожидалось, начали умирать через три дня, а медианная продолжительность жизни составила 5 и 10 дней соответственно.
При вскрытии рака или тератом у них не обнаружили, то есть смерть была вызвана другими причинами. Биохимические и гистологические анализы живых и мертвых трансгенных мышей выявили распространенный апоптоз клеток, атрофию тканей и нарушения функций печени, поджелудочной железы и тонкой кишки, более выраженные у 4Fj. Таким образом, фенотипические нарушения и преждевременная смерть при индукции репрограммирования клеток с большой вероятностью оказались следствием преимущественно недостаточности внутренних органов, а не опухолевого роста. Селективная индукция экспрессии OSKM в печени или кишечнике показала, что дисфункции этих органов возникают непосредственно из-за нее и достаточны для быстрой потери массы тела и смерти.
Выяснив это, исследователи создали трансгенных мышей, экспрессирующих OSKM во всем организме за исключением печени или кишечника. Это позволило выяснить, что экспрессия факторов Яманаки в кишечнике отвечает за ранние побочные эффекты репрограммирования in vivo, такие как диарея, низкая физическая активность и потеря массы тела, а в печени — приводит к тяжелой недостаточности этого органа и служит основной причиной смерти у репрограммируемых линий мышей.
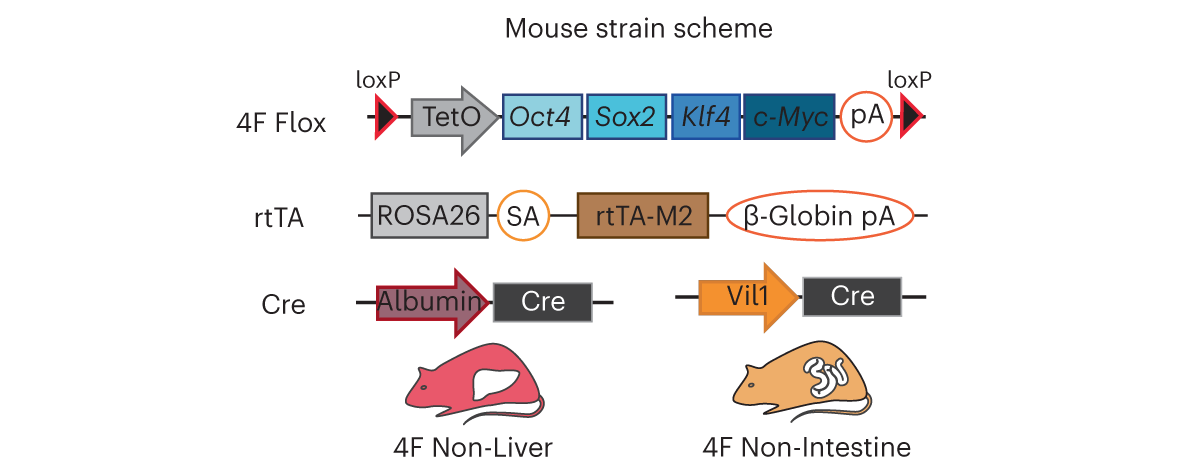
При индукции экспрессии OSKM во всем организме, кроме и печени и кишечника, медианная продолжительность жизни животных после ее начала возрастала до 30 дней, а максимальная — до 52 дней, что значительно превышает результаты всех предыдущих опытов по долгосрочному репрограммированию. У таких мышей причиной ранней смерти (до 15 дней от начала индукции) служила анемия с тромбоцитопенией, а поздней — недостаточность поджелудочной железы. Эксперименты по разной продолжительности временной индукции экспрессии OSKM у таких животных показали, что продолжительность 7–10 дней представляет собой наиболее длительный протокол индукции, который можно использовать безопасно. Применение такого протокола у мышей среднего возраста (10 месяцев) не вызывало существенных побочных эффектов и при этом снижало впоследствии биологический возраст сердца, селезенки, почек и мозга, измеренный по «эпигенетическим часам».
Таким образом, индукция экспрессии OSKM во всем организме, кроме и печени и кишечника, представляет собой приемлемую модель для длительного изучения различных эффектов репрограммирования in vivo. Также полученные результаты свидетельствуют, что селективные и транзиторные протоколы репрограммирования могут замедлять или даже обращать вспять процессы старения организма, заключают авторы работы.
Автор: Олег Лищук