Американские ученые проверили, можно ли восстановить работу мышц у мышей на поздних стадиях миодистрофии.
Оказалось, что одной инъекции генотерапевтического препарата достаточно, чтобы животные начали дольше ходить и больше времени проводить, стоя вертикально. Кроме того, мыши перестали умирать — хотя лечить их начали в тот момент, когда половина животных уже погибла от болезни. Работа опубликована в журнале Science Advances.
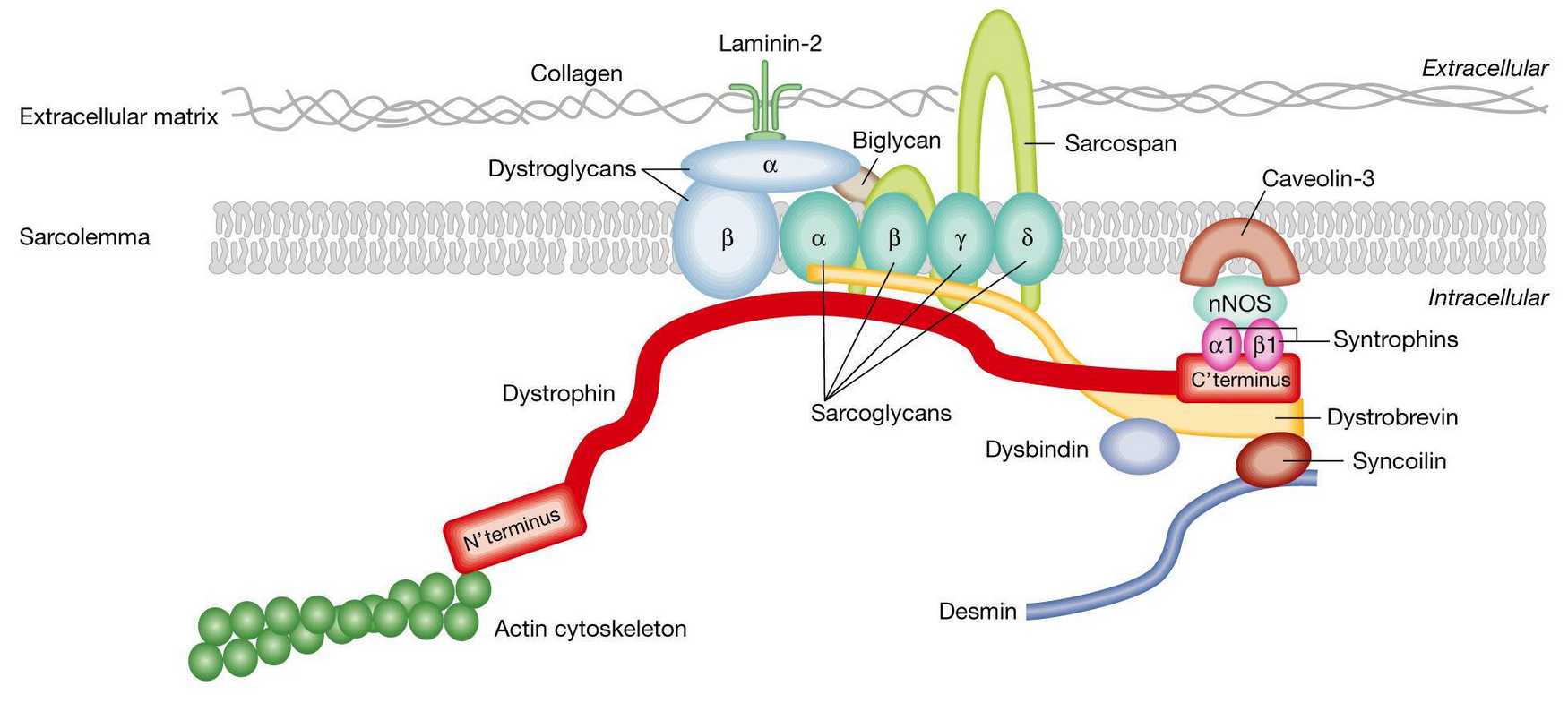
Мышечная дистрофия, или миодистрофия — это собирательное название для группы генетических болезней, в ходе которых мышечные клетки постепенно отмирают. Самая известная и распространенная из них — миодистрофия Дюшенна — вызвана мутацией в гене дистрофина. Этот белок связывает сократительные волокна внутри мышечной клетки с внеклеточным матриксом и сигнальными белками и передает усилие сокращения на окружающую ткань. Без него связующий комплекс не образуется, клетки работают вхолостую и получают искаженные сигналы — и в результате гибнут.
Скорость, с которой мышечные волокна перестают работать, в разных дистрофиях бывает разной. Иногда это происходит довольно медленно, и болезнь вызывает лишь легкий дискомфорт. Но миодистрофия Дюшенна, как и некоторые другие дистрофии, развивается быстро и приводит к прогрессирующему параличу. В результате больные часто не доживают до совершеннолетия или зрелости.
Лечения от миодистрофии пока не существует. Ученые пытаются разработать препараты на основе генной терапии и системы CRISPR/CAS — и уже опробовали их на мышах, свиньях и собаках. Такие препараты действительно восстанавливают производство нужного белка в мышцах. Но непонятно, насколько их можно применить к людям. Дело в том, что у людей миодистрофию обычно диагностируют довольно поздно — к этому времени многие мышечные волокна уже повреждены, и непонятно, возможно ли вернуть им работоспособность.
Чтобы это выяснить, группа исследователей под руководством Кевина Кэмпбелла (Kevin P. Campbell) из Университета Айовы работала с мышами линии myd. Они несут мутацию в гене Large1 и страдают дистрогликанопатией — у них не работает другой связующий мышечный белок, дистрогликан. А точнее, не производится фермент, который навешивает на дистрогликан углеводный «хвост», с помощью которого белок цепляется за внеклеточный матрикс. Эта модель, по мнению авторов работы, хороша тем, что, во-первых, дистрогликанопатии тоже встречаются у людей. А во-вторых, у мышей такая болезнь проявляется довольно серьезно: у них нарушена подвижность, они весят меньше обычно, а половина не доживает до года (хотя средняя продолжительность жизни мыши — 2-3 года в зависимости от линии). Поэтому на них можно проверить, реально ли восстановить работу мышц, когда они уже тяжело поражены.
Авторы работы взялись лечить мышей на 35-й неделе жизни — в этот момент половина их сородичей уже погибла от дистрофии, то есть повреждения мышц должны быть довольно серьезными. Им ввели аденовирусный вектор со «здоровым» вариантом гена Large1, а затем начали следить за их активностью и сравнивать с контрольной группой, которая никакого лечения не получала.
Исследователи подсчитали, что после генной терапии мыши проходят гораздо большую дистанцию, будучи предоставлены сами себе, и больше времени проводят, стоя вертикально и обнюхивая стенки вольера. Животные из контрольной группы лишились способности стоять на задних лапах за первые три месяца эксперимента. Кроме того, у мышей после терапии выросла сила мышечного хвата — хотя и не достигла уровня здорового животного.
Лечение сказалось и на внешнем виде мышей — они перестали терять вес. И несмотря на то, что они все равно, по словам исследователей, выглядели тощими, и толщина их мышц не достигла нормальных значений, выживали они гораздо лучше. В 60 недель, когда все животные из контрольной группы умерли (точнее, их усыпили из этических соображений, поскольку их состояние было критическим), в экспериментальной группе погибла только одна мышь из 14.
Исследователи проверили, что дело действительно в мышцах: они окрасили скелетную мышечную ткань и заметили, что волокна в среднем стали толще, а дистрогликана в них стало больше. То же самое заметили и в диафрагме — мышце, работа которой критична для больных миодистрофией.
В отличие от миодистрофии Дюшенна, дистрогликанопатии сказываются и на центральной нервной системе. Ген Large1 работает не только в мышцах, но и в мозге. Авторы работы измерили его экспрессию и выяснили, что генная терапия не помогает восстановить ее до нужного уровня. Этого можно было ожидать, с учетом того, что аденовирусный вектор мышам вводили внутривенно, а такие препараты не умеют преодолевать гематоэнцефалический барьер и проникать в мозг. Тем не менее, это означает, что для полноценного лечения дистрогликанопатии предстоит придумать, как решать и эту проблему тоже.
Авторы статьи отмечают, что не все миодистрофии, возможно, так удачно получится вылечить с помощью генной терапии. Ген Large1 довольно короткий, и легко влезает в аденовирусный вектор. Ген дистрофина длиннее, поэтому доставить его напрямую не получается — и приходится вместо него доставлять систему CRISPR/Cas, чтобы та отредактировала сломанный ген напрямую. Тем не менее, этот эксперимент показал, что мышцы млекопитающих достаточно пластичны и способны хотя бы частично восстановиться, если вовремя обеспечить их достаточным количеством нужного белка.
Автор: Полина Лосева
