Манипуляции с генами в стволовых клетках обеспечили нормальным гемоглобином двух больных с генетическими заболеваниями крови.
Метод генетического редактирования CRISPR/Cas берёт новые высоты: две биомедицинские компании, CRISPR Therapeutic и Vertex Pharmaceuticals, объявили об успехе в клинических испытаниях, в которых с помощью CRISPR/Cas пытались избавить людей от бета-талассемии и серповидноклеточной анемии – генетических заболеваний, возникающих из-за мутации в генах белков глобинов.
Про метод CRISPR мы писали неоднократно, это одна из самых популярных тем в современной биотехнологии. В самых общих чертах его суть такова: с помощью модифицированных бактериальных ферментов ДНК разрезают в строго определённом месте, после чего сама клетка зашивает разрез в соответствии с шаблоном, который в неё вводят вместе с разрезающим ферментом. Какой шаблон мы дадим клетке, так и будет выглядеть редактируемый участок генома. Метод оказался очень точным и сравнительно простым – по сравнению с другими способами генетического редактирования. И хотя время от времени к точности CRISPR возникают вопросы (не всегда, впрочем, оправданные), метод постоянно совершенствуется, и сейчас с CRISPR/Cas связано много надежд в том смысле, что он позволит быстро и просто избавлять нас от опасных мутаций.
В клиническом эксперименте у больного бета-талассемией брали стволовые клетки крови, с помощью CRISPR/Cas выводили из строя некий ген под названием BCL11A, и затем клетки с отредактированным геномом вводили обратно больным. В чём был смысл этих процедур? Все знают, что кислород в крови связывает белок гемоглобин. Но сам гемоглобин состоит из четырёх отдельных белков – двух альфа-глобинов и двух бета-глобинов. Альфа- и бета-глобины закодированы в отдельных генах. Бета-талассемия развивается тогда, когда в ген бета-глобина попадает мутация, из-за которой синтез бета-глобина резко падает. Из-за того, что становится мало бета-глобина, становится мало и гемоглобина. В некоторых случаях люди с бета-талассемией оказываются устойчивы к малярии, но в целом недостаток гемоглобина ни к чему хорошему не приводит – ведь это значит, что некому нести кислород в ткани и органы. Больным с особо тяжёлой формой талассемии помогают только регулярные переливания крови.
Но причём тут ген BCL11A, который выключали метолом генетического редактирования? Дело в том, что кроме обычного гемоглобина, у нас есть гемоглобин, который синтезируется только во время внутриутробного развития. Когда человек появляется на свет, «внутриутробный» гемоглобин перестаёт синтезироваться, уступая место обычному гемоглобину. Но если обычного не хватает, его вполне может заменить «внутриутробный», хотя они по биохимическим характеристикам отчасти отличаются. Плодный гемоглобин также состоит из четырёх белков – двух альфа-глобинов и двух гамма-глобинов. Нужно только разрешить организму синтезировать гамма-глобин.
Ген BCL11A кодирует белок, который запрещает синтез гамма-глобина и запускает синтез бета-глобина. Поэтому, если мы выключим BCL11A, то тем самым запустим синтез гамма-глобина. Но где именно его нужно выключить? Ведь не в нейронах же, не в мышцах и не эпителиальных клетках. Эритроциты у нас в крови постоянно обновляются за счёт специальных стволовых клеток костного мозга. В этом и был смысл генетической терапии: отключая BCL11A в стволовых клетках, из которых образуются эритроциты, мы тем самым обеспечиваем организм функционирующим зародышевым гемоглобином – стволовые клетки, вернувшись обратно к больному, будут жить и производить нормальные эритроциты, обеспечивающие ткани тела кислородом.
Как пишет портал The Scientist, больному бета-талассемией генетическое редактирование со стволовыми клетками проделали прошлой осенью, и сейчас он вполне обходится без регулярных переливаний крови, за счёт которых он жил последние 16 лет.
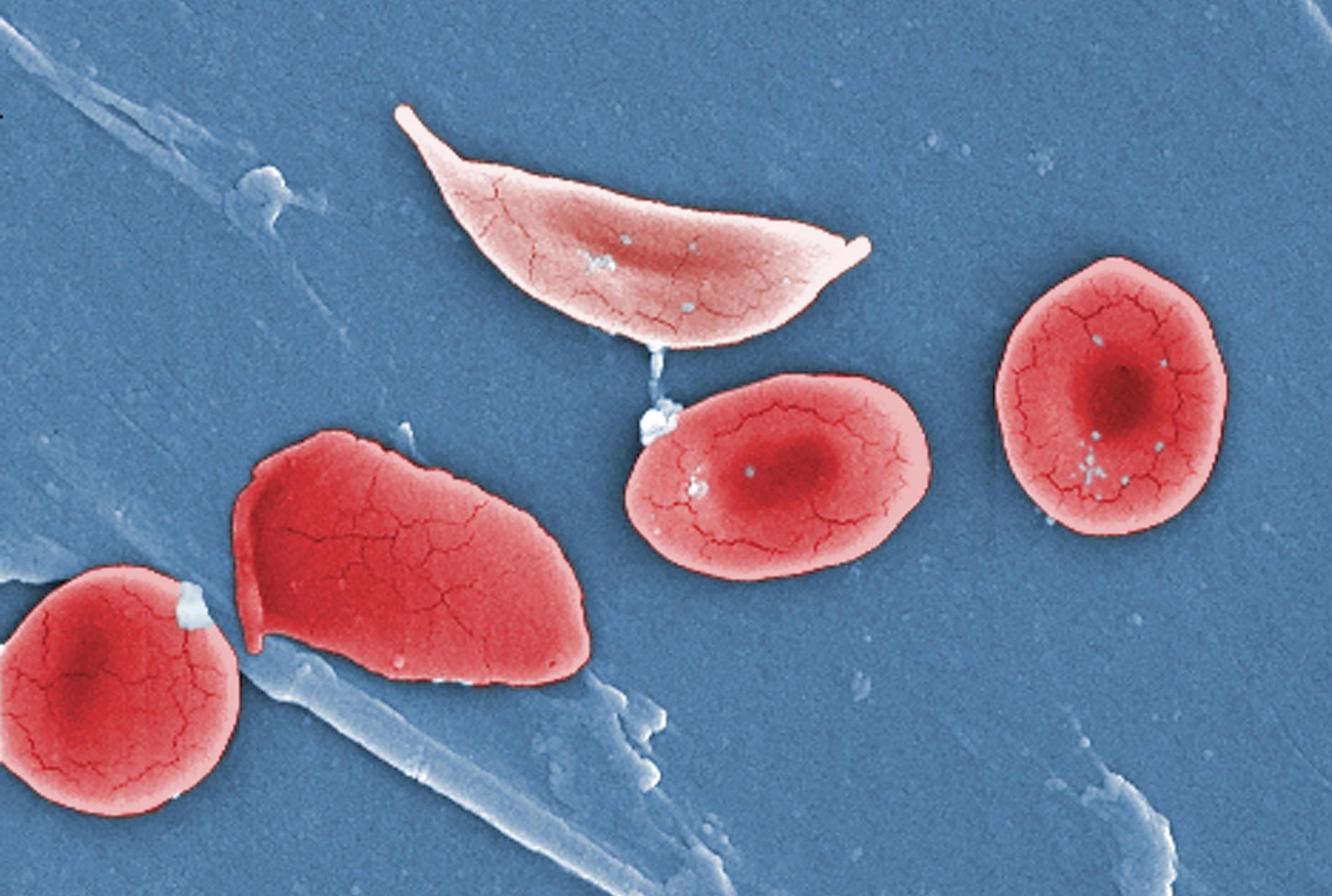
У другого человека, который участвовал в эксперименте, была серповидноклеточная анемия, которая также развивается из-за мутаций в генах глобинов – в результате гемоглобин меняет структуру и начинает плохо связывать кислород. Эритроциты с неправильным гемоглобином приобретают серповидную форму и могут прилипать друг к другу, формируя тромбы в небольших сосудах. У этого больного после генетического редактирования исчезли все характерные симптомы серповидноклеточной анемии, связанные с микротромбами.
Перед тем, как ввести обратно модифицированные стволовые клетки, у обоих участников эксперимента специальным препаратом убирали все оставшиеся в организме стволовые клетки с болезнетворными мутациями, и единственные незначительные побочные эффекты, проявившиеся у пациентов, были связаны как раз с этим препаратом. Впрочем, пока что прошло ещё не очень много времени, чтоб насчёт обоих пациентов можно было окончательно успокоиться.
Обычно про медицинское использование CRISPR говорят в связи с редактированием эмбрионов, когда имеют в виду получить организм, полностью, в каждой своей клетке, избавленный от ненужной мутации. Но, как видим, даже если не замахиваться на эмбрионы, этот метод генетического редактирования позволяет получить весьма впечатляющие результаты. Кстати, два года назад мы писали о другом случае, когда человека удалось вылечить от очень тяжёлого генетического заболевания, отредактировав ген в стволовых клетках, но тогда для редактирования гена использовали другой подход.
Автор: Кирилл Стасевич