Генетики создали инструмент для редактирования генома, который не нуждается в разрезании обеих цепей молекулы ДНК и может «откатывать назад» мутации, превращая пары нуклеотидов A-T в G-C пары.
До этого подобные редакторы были способны менять только G-C на A-T пары, то есть охватывали лишь половину вариантов мутаций. Работа опубликована в журнале Nature.
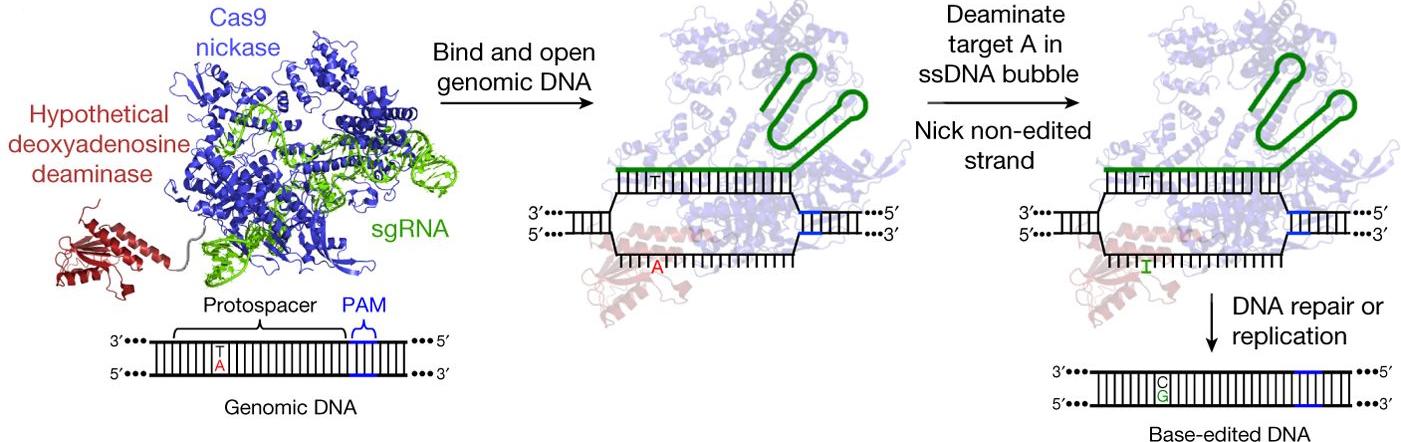
Примерно половина болезнетворных мутаций в ДНК человека связана со спонтанным отделением аминогруппы (дезаминирование) от нуклеотида цитозина (С), что ведет к замене пар C-G на пары T-A. Дезаминирование аденина, в свою очередь, ведет к появлению инозина, который воспринимается полимеразами как гуанин, и эта реакция могла бы быть способом «откатить» превращение C-G в T-A. Однако до сих пор ферментов, способных успешно дезаминировать аденины в ДНК, не существовало. Ученым удалось разработать редакторы адениновых оснований (adenine base editors, ABEs), создав их на основе адениновых деаминаз тРНК, «пришитых» к модифицированной системе CRISPR-Cas9. Система в данном случае необходима, чтобы находить правильную последовательность ДНК (подробнее о методах геномного редактирования, связанных с CRISPR, можно прочитать в нашем материале).
Наиболее распространенные редакторы оснований способны, наоборот, превращать пары C-G в пары T-A. Они состоят из нескольких компонентов: модифицированной системы CRISPR-Cas9, которая не способна вносить двухцепочечные разрезы в ДНК, но способна находить нужный ее участок; цитидиловой деаминазы, способной заменять цитозин на урацил в пятинуклеотидном окне одноцепочечного «пузыря», который создает на ДНК белок Cas9; и ингибитора урациловой гликозилазы, который препятствует вырезанию урацила и ряду других процессов, влияющих на чистоту продукта редактирования. Никазная активность системы позволяет ей также совершать одноцепочечный разрез на «противоположной», нередактируемой цепи ДНК, чтобы активировать работу системы репарации ДНК, которая заменит там гуанин на аденин. Такие редакторы успешно работают в геномах мышей, растений, дрожжей, рыб и даже человеческих эмбрионов. Они не требуют для работы ДНК-шаблонов. Подробнее почитать о них можно здесь.
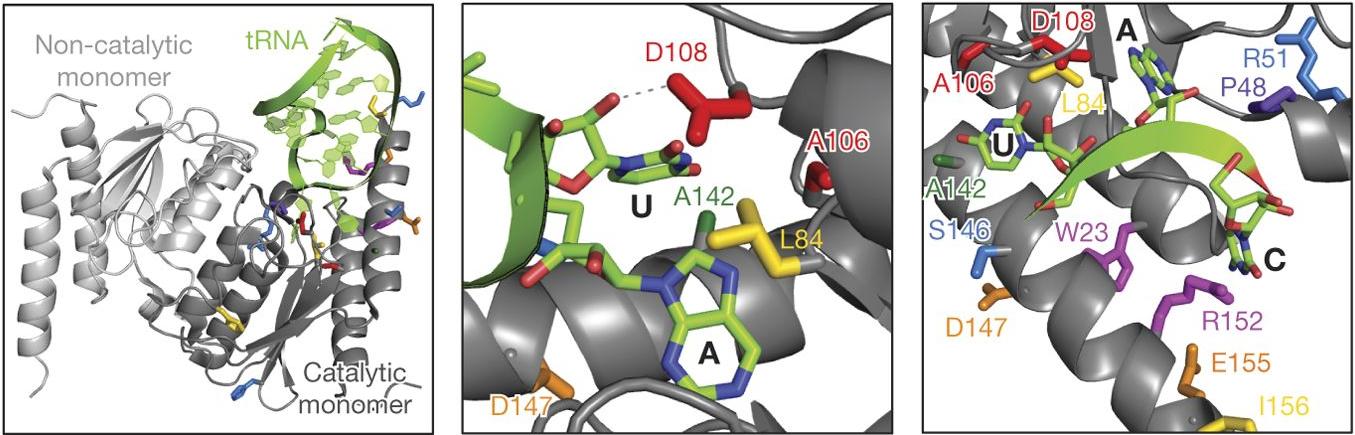
Для того, чтобы создать подобный же редактор, но превращающий пары A-T в G-C, ученые из Гарварда и MIT выбрали ряд известных адениновых деаминаз кишечной палочки, человека и мыши, которые успешно дезаминировали свободные аденины, аденозины, аденозины в составе РНК и аденозины в спаренных РНК-ДНК гетеродуплексах. Их вносили в клетки бактерий с помощью плазмид и изучали их активность. Оказалось, что в своем исходном виде ни один из ферментов не мог эффективно дезаминировать аденозины в двухцепочечной ДНК.
Ученые воспользовались методами белковой инженерии и направленной эволюции, имитирующей естественный отбор в строго заданных условиях. Они работали с бактериями, имеющими мутации в гене резистентности к антибиотикам. Их обрабатывали антибиотиками, и резистентность к ним возникала у бактерий, у которых геномное редактирование (чинящее гены резистентности) происходило успешно. Наилучшие результаты показала деаминаза тРНК TadA. Для повышения эффективности работы фермента был проведен ряд его модификаций, в частности, этап селекции показал, что для успешной работы с ДНК ему необходима мутация в позиции D108 в соответствующем гене, и такая мутация была в него внесена. Кроме того, выяснилось, в том числе, что эффективность работы фермента повышается в случае его димеризации.
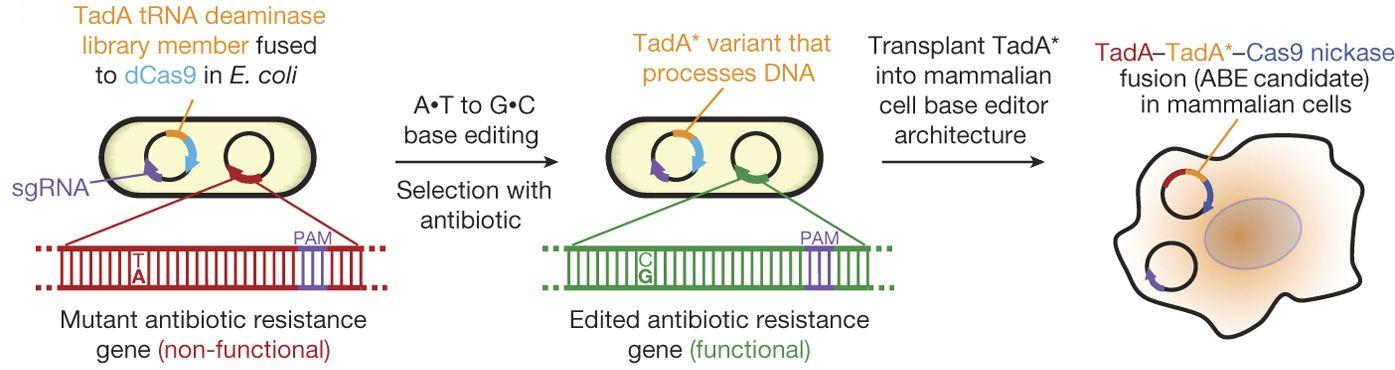
В результате в седьмом поколении ученые получили эффективные редакторы (ABE7.10), заменяющие нужные A-T пары на G-C пары с эффективностью до 50 процентов. При этом уровень побочных вставок и делеций составлял, в среднем не более 0,1 процента. Более распространенные методы геномного редактирования на основе CRISPR-Cas9 систем связаны с внесением двойных разрывов в цепи ДНК, и этот процесс, как правило, порождает гораздо больше побочных вставок и делеций. Кроме того, редактирование с помощью ABEs оказалось более точным, поскольку его работа производила меньшее число внецелевых замен.
Ученые отдельно провели эксперимент, демонстрирующий эффективность работы ABE при редактировании болезнетворных мутаций. Известно, что мутации в гене бета-глобина вызывают широкий спектр заболеваний крови. Некоторые их носители, однако, резистентны к ним благодаря мутациям в промоторных областях генов гамма-глобина. Ученые разработали специфический редактор ABE, который вносит мутации в эти области, заменяя А-Т на G-C. Он продемонстрировал 29- и 30-процентную эффективность на двух промоторах в клетках HEK293T.
Подобный же эксперимент был проведен с геном HFE, мутация в котором вызывает у людей гемохроматоз. Фермент успешно сработал в 28 процентах случаев, заменив 845-ый нуклеотид в гене, и соответственно, изменив аминокислоту соответствующего балка с тирозина на цистеин.
Ученые отмечают, что превращение цитозина в тимин или урацил происходит от 100 до 500 раз в день в каждой клетке человека. Этот процесс может приводить к возникновению мутаций в важных участках ДНК и вести к возникновению самых разных генетических заболеваний. Получение геномных редакторов, способных восстанавливать исходную последовательность ДНК, как в случае с А-Т, так и в случае с G-C парами — важный шаг для методов генной инженерии.
А узнать о первых экспериментах с человеческими эмбрионами и редакторами, превращающими пары C-G в пары T-A, можно здесь.
Автор: Анна Казнадзей