Необходимость адаптации к экстремально высоким температурам привела совершенно разных млекопитающих — сусликов и двугорбых верблюдов — к одному и тому же эволюционному решению. А именно — к одинаковым мутациям в гене, отвечающем за болевую чувствительность при контакте с горячими предметами.
Механизм адаптации удалось обнаружить ученым из Йельской медицинской школы и Университета Висконсина, работа опубликована в журнале Proceedings of the National Academy of Sciences.
Болевые ощущения при контакте с горячими предметами необходимы животным, чтобы избегать повреждения тканей. Если речь идет о млекопитающих, то обычно порог болевой чувствительности находится приблизительно на уровне 40 градусов Цельсия или чуть выше. Эта температура существенно ниже, чем та, при которой действительно начинают развиваться повреждения (и это, например, позволяет ученым создавать безопасные болевые тесты для людей). Роль такого заниженного порога понятна — благодаря ему животные стараются избежать самой возможности получения ожогов. Однако если речь идет об обитателях экстремально жарких мест планеты, то излишне низкий болевой порог будет им только мешать. Поэтому можно ожидать, что у млекопитающих из числа обитателей пустыни болевой порог высокой температуры будет существенно выше, чем у остальных. В новой работе ученым не только удалось доказать наличие такой адаптации у тринадцатиполосных сусликов (Ictidomys tridecemlineatus), но и объяснить механизм ее возникновения.
Исследование началось с теста на горячей платформе. При этом животных помещали на площадку с двумя участками разной температуры: на одном она составляла 25 градусов Цельсия, на другом была выше. Исследователи постепенно нагревали второй участок и следили за тем, сколько времени проводили на нем мышь или суслик и как это время зависело от температуры. Как оказалось, чувствительность обитателей пустыни к горячему существенно ниже, чем у мышей — первые пытались покинуть горячий участок, только когда он нагревался примерно до 50 градусов, вторым было достаточно 40 градусов.
Поскольку известно, что рецепторами высокой температуры у млекопитающих являются мембранные белки, кодируемые геном TRPV1, дальнейшее исследование сосредоточилось на отличиях в строении этих белков (они идентичны только на 90 процентов) у сусликов и других животных.
Белок TRPV1 представляет собой типичный рецептор из семейства TRP, работа которого основана на пропускании положительно заряженных ионов Na+ и/или Ca2+. TRPV1 состоит из шести трансмембранных доменов, образующих канал для ионов натрия и кальция, а также двух цитозольных кусков (N- и С-концевого), которые взаимодействуют с различными кофакторами. Механизм чувствительности этого белка к температуре сводится к тому, что нагревание выше некоторого предела приводит к изменению его конформации, что ведет к открытию канала, деполяризации клеточной мембраны и передаче нервного сигнала определенной группой нейронов в чувствительные ганглии спинного мозга и дальше в ЦНС. Важно отметить, что срабатывание TRPV1 может вызывать не только высокая температура, но и, например, такое вещество, как капсаицин (содержится в остром перце), — этим объясняется «горячий» вкус острых блюд.
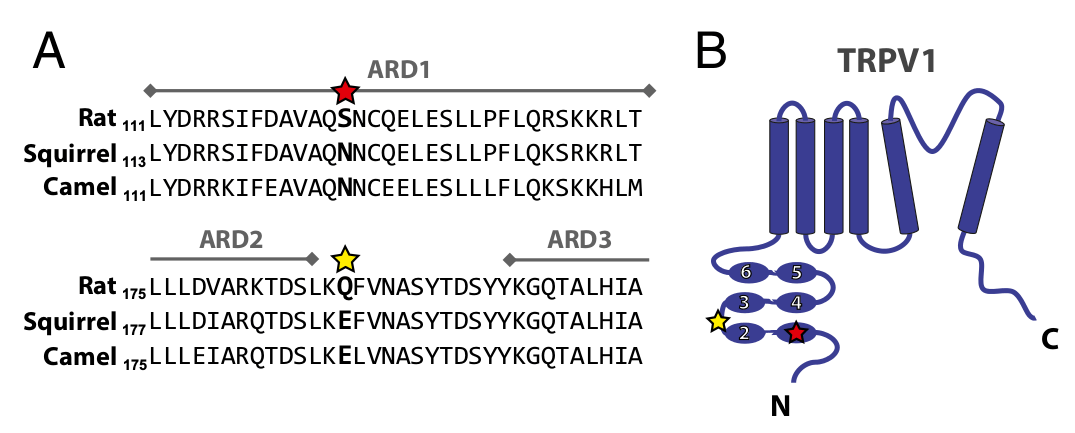
В исследовании ученые сначала убедились в том, что нужные нейроны сусликов действительно содержат на своей мембране белок TRPV1. После этого авторы установили, что эти нейроны реагируют на капсаицин так же, как как нейроны мышей. Затем в ходе экспериментов на индивидуальных фрагментах мембран с разными вариантами TRPV1 было установлено, что белок сусликов действительно существенно более устойчив к высокой температуре, но при этом реагирует на капсаицин так же, как белок мышей и крыс. После того как ученые убедились в этом, они клонировали вариант TRPV1 из генома другого «экстремофила» — двугорбого верблюда, или бактриана. Как оказалось, верблюжий вариант TRPV1 реагировал на капсаицин и температуру совершенно таким же образом, притом что мышиный вариант гена, конечно, существенно ближе к варианту сусликов, чем верблюжий. В ходе последующего анализа по фрагментам ученым, наконец, удалось узнать, где находится мутация, объединяющая пустынных обитателей на уровне ДНК.
Как оказалось, речь идет не об одной, а о паре мутаций, которые возникли в геномах животных независимо. Они расположены в N-концевой цитозольной части белка в районе двух анкириновых доменов. Подобная замена двух аминокислот в мышиной версии TRPV1 ведет к появлению точно такого же по свойствам белка — чувствительного к капсаицину и устойчивого к температуре. В свою очередь, замена мутировавших аминокислот в белках суслика и верблюда возвращает им исходную чувствительность к температуре или (в некоторых вариантах) делает их даже еще более термочувствительными.
С одной стороны, новая работа может служить ярким примером конвергентной эволюции, механизм которой полностью понятен на молекулярном уровне. С другой стороны, она является важным вкладом в исследования биохимии рецепторных белков и показывает, как очень малые изменения могут быть использованы для тонкой настройки чувствительности терморецепторов.
Автор: Александр Ершов
