Ученые из Японии успешно применили невирусный метод для внедрения генов в организм приматов. Технология позволила получить трансгенных макак-крабоедов со стабильной экспрессией чужеродных генов во всех тканях. Это снимает имевшиеся ограничения в создании трансгенных обезьян.
Биотехнологические исследования на мышах — наиболее распространенном модельном организме — далеко не во всем можно применять на людях. Такие модели часто не воспроизводят сложные человеческие заболевания из-за заметных различий в физиологии. Приматы, такие как макаки-крабоеды, генетически близки к людям, но их генетическая модификация до сих пор требовала вирусных систем, которые имеют ограничения.
Использование некоторых вирусов требует специальных лабораторий повышенной безопасности. Кроме того, вирусы могут переносить только небольшие фрагменты ДНК (до 8-10 тысяч пар оснований) и вызывают случайные мутации. Еще одна проблема — невозможность проверить успешность модификации до переноса эмбрионов в матку. Это приводит к рождению животных без нужных генов, что противоречит этическим нормам.
Группа японских ученых разработала альтернативу вирусным методам. Статья об этом вышла в журнале Nature Communications. Биологи использовали систему piggyBac, которая работает иначе, чем вирусная. Она основана на транспозонах — «прыгающих генах», способных перемещаться внутри генома.
PiggyBac открыли в 1980-х годах у насекомых, но позже адаптировали для млекопитающих. Ключевой компонент системы — фермент транспозаза, который вырезает участок ДНК, окруженный специфическими последовательностями, транспозон, и встраивает его в новое место. В отличие от вирусов, piggyBac не оставляет следов в геноме после удаления транспозона и может переносить гены длиной до 200 тысяч пар оснований.
Исследователи начали с того, что оптимизировали метод на мышах — вводили компоненты piggyBac вместе со сперматозоидами в зрелые яйцеклетки. При концентрации вектора 10 нанограммов на микролитр 62% эмбрионов демонстрировали стабильную экспрессию флуоресцентных белков. Все родившиеся мыши (семь из 21 эмбриона) имели встроенные гены, которые передались 72% потомства.
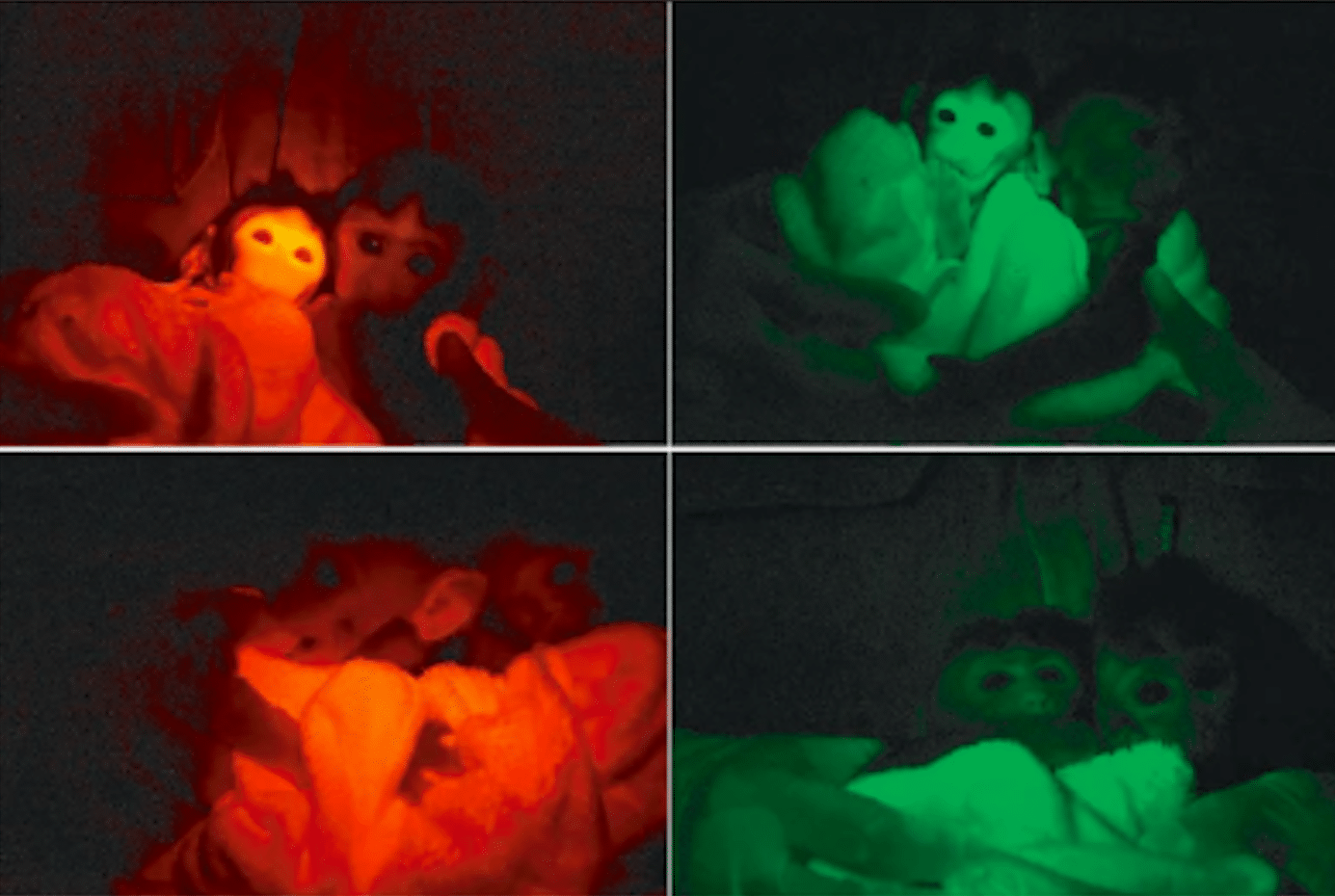
Затем метод применили к макакам-крабоедам. Из 34 эмбрионов 32 показали активность флуоресцентных маркеров. После переноса 20 эмбрионов четырем самкам родились три детеныша. У двух из них красный флуоресцентный белок локализовался в мембранах клеток, а зеленый — в ядрах. Экспрессия генов подтвердилась во всех тканях, включая мозг, сердце и половые клетки. При этом она варьировалась: в сердце и мышцах достигала 95-100%, а в печени и мозге снижалась до 30%.
Анализ ДНК показал, что гены встроились в разные участки генома, но не в критические зоны, такие как стартовые сайты транскрипции. У выживших обезьян обнаружили до четырех сайтов интеграции, тогда как у погибших их было восемь-девять. Это указывает на возможную связь между числом вставок и жизнеспособностью.
Новый метод устранил ключевые ограничения вирусных подходов: риск заражения, размер генов и невозможность ранней проверки эмбрионов. Однако остаются проблемы мозаицизма — неравномерной экспрессии генов в клетках.
В будущем биотехнологи планируют усовершенствовать систему piggyBac для контроля времени встройки генов и повышения точности. Это откроет путь к созданию приматов с моделями нейродегенеративных, иммунных и других заболеваний, которые невозможно изучить на грызунах.
Автор: Илья Гриднев