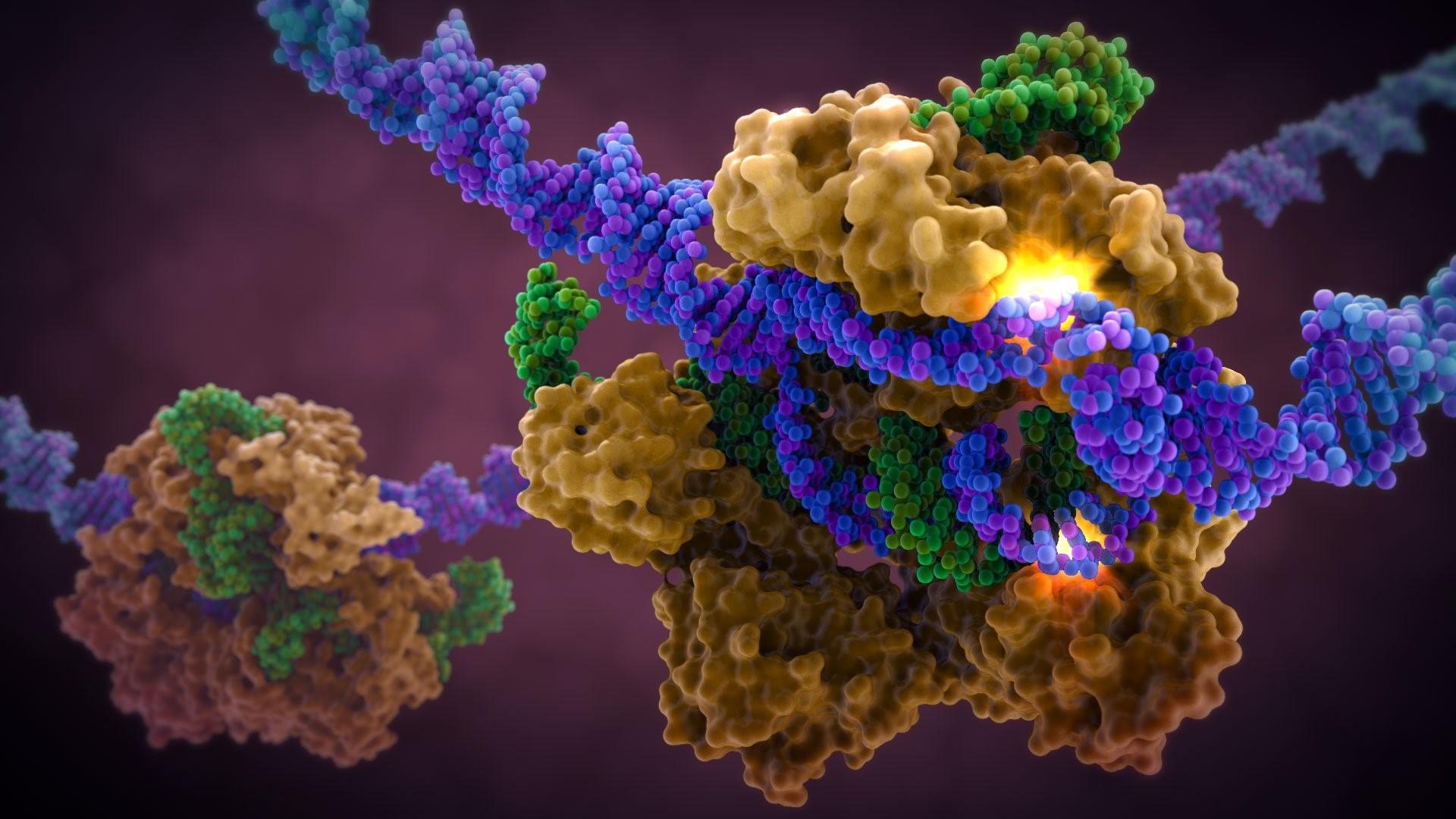
Исследователи Сколтеха и их коллеги из России и США описали две новые компактные нуклеазы Cas9, используемые системой CRISPR-Cas для разрезания ДНК, которые могут пополнить набор инструментов для редактирования генома.
Ученые показали, что одна из двух нуклеаз может работать в клетках человека, что открывает перспективы для ее применения в биомедицинских приложениях. Результаты исследования опубликованы в журнале Nucleic Acids Research.
Технология геномного редактирования CRISPR-Cas заимствована у бактерий и основана на использовании Cas нуклеаз, которые способны с помощью CRISPR РНК разрезать генетические последовательности, выполняя роль лезвий в «генетических ножницах», открытие которых было удостоено Нобелевской премии (2020 год, Эммануэль Шарпантье и Дженифер Дудна).
Для исследовательских целей в качестве нуклеазы Cas9 чаще всего используют нуклеазу из бактерий-стрептококков, Streptococcus pyogenes (тип II-A SpCas9). Эта нуклеаза эффективна и относительно проста: один крупный белок одновременно связывается с CRISPR РНК и разрезает ДНК. Кроме того, SpCas9 для узнавания мишеней требует достаточно короткую PAM-последовательность “NGG” – несколько нуклеотидов, фланкирующих целевой сайт на ДНК, необходимые для успешного разрезания генома.
SpCas9 — крупный белок, а это может вызывать проблемы в случаях, когда необходимо, например, использовать частицу аденоассоциированного вируса (AAV) в качестве средства доставки «генетических ножниц» в клетку. В идеале в одной AAV частице должны уместиться и ген, кодирующий Cas белок, и последовательности, кодирующие направляющие CRISPR РНК, а это требует меньших по размеру белков Cas9. В то же время, для более коротких нуклеаз, как правило, требуются более длинные и сложные PAM-последовательности, поэтому исследователям зачастую приходится искать компромисс между размером белка и выбираемыми мишенями.
Авторы статьи – недавно защитившийся аспирант Сколтеха из лаборатории профессора Северинова Яна Федорова и сотрудник лаборатории Александра Васильева вместе с коллегами− описывают две новые небольшие нуклеазы Cas9, полученные из бактерии Defluviimonas sp.20V17, обитающей в гидротермальных источниках, и бактерии Pasteurella pneumotropica, паразитирующей у грызунов и других млекопитающих. Эти нуклеазы одновременно обладают достаточно малым для доставки в AAV векторе размером и имеют относительно короткие PAM-последовательности (“NNRNAY” и “NNNNRTT”), что является двойным преимуществом в случае ферментов Cas9.
Новые нуклеазы относятся к системам CRISPR-Cas типа II-C, где эффекторы Cas9 часто имеют меньший размер, чем SpCas9. Структура II-C нуклеаз очень похожа на строение SpCas9, но в то же время эти белки обладают рядом уникальных особенностей: у них отсутствует несколько субдоменов, а домен, отвечающий за взаимодействие со скаффолдом направляющей РНК, имеет меньший размер, что делает нуклеазы компактнее.
«Да, эффекторам Cas9 типа II-C, как правило, требуются более длинные PAM-последовательности, но это лишь наблюдение, основанное на изучении ограниченного количества описанных на сегодняшний день II-C нуклеаз. Вот, например, в бактерии Staphylococcus auricularis недавно был обнаружен белок SauriCas9, который аналогично белку PpCas9 требует короткую PAM-последовательность – всего лишь две “буквы” (“NNGG”). Думаю, в скором времени будут обнаружены и другие ферменты Cas9 типа II-C, требующие коротких PAM-последовательностей. Малоразмерные Cas9 с разными требованиями к PAM увеличивают число потенциальных ДНК-мишеней в геномах эукариот и прокариот, которые можно редактировать CRISPR-Cas системами», − говорит Яна Федорова.
Эксперименты in vitro и в бактериях показали эффективность двух новых нуклеаз в разрезании ДНК, а нуклеаза PpCas9, полученная из бактерии Pasteurella Pneumotropica, также оказалась активна в клетках человека. Кроме того, было установлено родство PpCas9 белка с другими нуклеазами Cas9 − Nme1Cas9 и Nme2Cas9, активность которых в эукариотических клетках была показана ранее. Для оценки эффективности PpCas9 в эукариотах потребуются дополнительные исследования, однако, по мнению авторов, этот белок может быть использован в ряду с традиционными нуклеазами, которые сегодня используются в микробных биотехнологиях и биомедицине для редактирования генома, и расширить применение CRISPR-Cas систем.
Исследователи отмечают, что предварительные исследования нецелевого разрезания PpCas9 ДНК указывают на достаточную специфичность этого фермента, однако необходимо провести полное исследование специфичности PpCas9 более сложными методами. «PpCas9 к тому же проявляет избирательность в выборе мишеней в эукариотах, что может уменьшать число потенциальных целевых сайтов в геноме и тем самым ограничивает применение белка. Причины и механизмы такой избирательности PpCas9 будут предметом дальнейших исследований», − добавляет Яна Федорова.