Китайский ученый Цзянькуй Хэ в понедельник объявил, что первые в истории генно-модифицированные люди уже живут среди нас: речь идет рождении девочек-близнецов, у которых с помощью технологии CRISPR был искусственно изменен ген, отвечающий за восприимчивость к ВИЧ.
В этой сенсационной истории пока много неясного. В первую очередь, о самом эксперименте автор объявил не общепринятым способом — с помощью публикации в научном журнале, а в видеоролике на YouTube. Университет, где работал Цзянькуй Хэ, открестился от этого проекта, коллеги осудили экспериментатора, а китайские власти начали расследование. Мы попросили ученых рассказать, насколько реалистичной выглядит история, рассказанная китайским ученым, насколько доступен метод генной модификации человеческих эмбрионов, какие риски и опасности могут возникать в таких экспериментах, почему в большинстве западных стран такие эксперименты запрещены и можем ли мы в скором будущем ждать генно-модифицированных спортсменов, интеллектуалов или «служебных людей».
Что произошло?
Если очень коротко: Цзянькуй Хэ из Южного университета науки и технологий в Шэньчжэне отредактировал методом CRISPR/Cas9 зиготу, полученную в результате оплодотворения яйцеклетки матери сперматозоидом ВИЧ-инфицированного отца (с неопределяемым уровнем вирусной нагрузки), модифицировав в ней ген CCR5. Эта мутация делает человека маловосприимчивым к риску заражения ВИЧ. Затем эмбрион была подсажен матери с помощью стандартных методов, используемых при экстракорпоральном оплодотворении (ЭКО), и в результате родились девочки-близнецы — Лулу и Нана.
Хэ заявляет, что еще одна женщина сейчас беременна генно-модифицированным ребенком, а семь других пар участвуют в эксперименте, в настоящее время, впрочем, приостановленном «в связи с текущей ситуацией».
Что такое CRISPR-Cas
История систем CRISPR-Cas далека от человека — в природе они найдены у организмов, очень сильно отличающихся от нас: бактерий и архей. В этих сравнительно простых клетках CRISPR-Cas представляет собой аналог адаптивного иммунитета. Непосредственно CRISPR — это аббревиатура, описывающая участок бактериального генома, где записана информация о тех вирусах, с которыми встречались предки этой клетки. Эти данные хранятся в виде библиотеки коротких кусочков вирусной ДНК, которую бактерия получает по наследству и может пополнять самостоятельно.
Если бактерия сталкивается с вирусом, информация о котором записана в CRISPR-библиотеке, Cas-белки могут распознать и уничтожить «непрошенного гостя». Для этого необходимо представить данные из библиотеки в виде молекулы РНК. Комплекс Cas-РНК сканирует ДНК и ищет соответствия, а при совпадении — режет.
Причем же здесь генетические болезни человека? Ключевое здесь — умение Cas-белков резать ДНК в четко заданном участке. Идея заключается в следующем: вместо того, чтобы считывать РНК с CRISPR-библиотеки, ученые просто берут нужную короткую молекулу РНК (она называется гидовой, или направляющей), соответствующую определенному месту в геноме. В комплексе с белком Cas (из всего природного разнообразия CRISPR-Cas-систем для работы с животными клетками чаще всего используется белок Cas9 из стрептококка) направляющую РНК вводят в клетки. Там Cas9 находит нужный участок, например, содержащий мутацию, и вносит разрез.
Однако это еще не все. Чтобы исправить вредную мутацию, кроме комплекса белка Cas9 с РНК, в клетку нужно добавить еще «заплатку», содержащую нужную последовательность ДНК. Используя ее, системы репарации клетки «починят» порезанную ДНК и вместо мутации на этом месте появится другая, «нормальная» последовательность.
Нужно это не только и не столько для лечения.
Технология редактирования генома открывает новые горизонты для его исследователей. Возможность варьировать последовательность ДНК живых организмов существовала и раньше, но по сравнению с генно-инженерными методами, существовавшими до «эпохи CRISPR-Cas» (которая, к слову, началась всего шесть лет назад), предлагаемый механизм достаточно прост и эффективен. Он помогает быстро создавать модельные системы для самого разного класса задач, как из области фундаментальной генетики, так и в прикладной медицине, и уже стал своеобразным must have во многих биологических лабораториях.
Подробнее об этом методе можно прочесть в нашем материале.
Почему в результатах Хэ сомневаются?
Сомнения возникли из-за того, в какой форме было объявлено о новом результате. Во-первых, Хэ не опубликовал свою работу в научном журнале, нарушив обычную процедуру для объявления о результатах экспериментов. Статью в журнале перед публикацией обычно читают и оценивают несколько рецензентов и редактор.
Вместо этого Хэ записал ролик на YouTube, в котором объявил не только об успехе, но и о том, что родившихся девочек увидеть нельзя, а данные об их семье засекречены. Масла в огонь добавил Южный университет, где формально числится ученый, — там заявили, что он уже полгода находится в неоплачиваемом отпуске и об этой работе им ничего неизвестно.
Во-вторых, есть и сомнения более общего рода: почему, задается вопросом известный научный журналист Леонид Шнайдер, для столь эпохального эксперимента был выбран именно ВИЧ, а не какая-нибудь врожденная смертельная генетическая болезнь?
Со Шнайдером солидарен и Пауль Калиниченко — профессор Московского государственного юридического университета имени Кутафина (МГЮА), исследующий мировые практики законодательного регулирования генетических экспериментов. «Это очень странный пример. ВИЧ — это не генетическое заболевание, то есть при редактировании генома происходит не лечение, а лишь снижение риска заражения. Зато ВИЧ — заболевание очень известное. Потому что пороки сердца или гемофилия — редкие, они не так будоражат людей, многие о них вообще не слышали. С ними сенсации не создать, а с ВИЧ — можно, это пандемия, некая трибуна. Я из-за этого и усомнился в достоверности [заявлений Хэ]», — говорит Калиниченко.
А рождение генно-модифицированных людей вообще возможно?
Да, вполне — и с практической возможностью подобной работы согласны большинство экспертов. Более того, Хэ находится в одном из лучших мест для проведения таких исследований.
«Проверить сказанное сложно, но, оценивая гипотетическую возможность, мы можем опираться на историю предыдущих лет. И мы знаем, что первыми геном эмбриона человека отредактировали именно китайские ученые — этот эксперимент был проведен еще в 2015 году (правда не слишком успешно). Там речь шла о нежизнеспособных зиготах, то есть эмбрион не подсаживали матери. Годом позднее наш знаменитый соотечественник Шухрат Миталипов, работающий сейчас в Университете здоровья и наук Орегона, развил и закрепил этот опыт», — рассказывает Павел Волчков, заведующий лабораторией геномной инженерии Московского физико-технического института (МФТИ).
Миталипов по всем канонам опубликовал свою статью в Nature. В ней доказывается возможность редактирования генома человека на стадии эмбриона с целью избежать проявления генетического заболевания — гипертрофической кардиомиопатии, для которой сегодня существует только симптоматическое лечение. Препарат, редактирующий ген, вводили в зиготу — эмбрион на стадии его одноклеточного развития. Затем зиготе давали развиться до бластоцисты — первой многоклеточной стадии. Путем анализа генома клеток было показано, что редактирование состоялось. На этом эксперимент прервался.
«Как видно, все основополагающие работы были сделаны, оставалось только подсадить эту бластоцисту обратно матери — то есть проделать совершенно рутинную операцию, обычную при ЭКО, которым пользуются женщины, допустим, с непроходимостью маточных труб. Почему ранее эксперимент всегда прерывали? Чтобы не проводить незаконный эксперимент на человеке. Дело в том, что эксперименты на эмбрионах законны, так как в разных странах его до определенного возраста человеком не считают. Вот до этого оговоренного в законе возраста и доращивали многоклеточную стадию», — поясняет Волчков..
Насколько это сложно?
Судя по всему, вывести генно-модифицированных людей не очень сложно — конечно, в условиях современной лаборатории, занимающейся редактированием генома и, желательно, работающей при большой репродуктивной клинике.
«Технология микроинъекции в оплодотворенную зиготу, с помощью которой проводится редактирование генома, — это несложно, — говорит Павел Волчков. — А Хэ работал в лаборатории, где делают ЭКО. В такой лаборатории всегда под руками имеется большое количество оплодотворенных яйцеклеток от родителей, которые пытаются родить, — обычно для ЭКО забирают больше яйцеклеток, чем необходимо, на случай неудач, и они остаются в клинике. Значит, там постоянно есть возможность закалывать инструменты генетического редактирования в зиготы, давать им развиваться до определенной стадии и оценивать эффективность это процедуры».
«Методика состоит из нескольких процедур. Эмбриологические процедуры — работа с эмбрионом, с зиготой, с микроманипулятором, инъекция — могут варьироваться от лаборатории к лаборатории. Хэ, по крайней мере, по его словам в ролике, осуществлял их тем же способом, что и мы в нашей работе», — говорит генетик, проректор Российского национального исследовательского медицинского университета (РНИМУ) имени Пирогова, заведующий лабораторией редактирования генома научного центра имени Кулакова Денис Ребриков. Ранее научная группа под его руководством провела практически такой же эксперимент с человеческими эмбрионами, с той только разницей, что отредактированные яйцеклетки не были подсажены матери.
По словам Ребрикова, речь идет о стандартной процедуре лечения мужского бесплодия по протоколу ИКСИ (ICSI, Intracellular Sperm Injection Protocol), применяемой в том случае, когда сперматозоиды слишком неподвижны для зачатия: «Одновременно со сперматозоидом мы микроманипулятором вносим в яйцеклетку смесь для генного редактирования, получая тем самым зиготу», — говорит ученый.
«Для редактирования обычно используют стандартные покупные ферменты типа Cas9. Вариантов ферментов на сегодня довольно много, поэтому нельзя сказать, какой именно фермент использовал Хэ. А вот остальные компоненты реакционной смеси: направляющую фермент гидовую РНК, олигонуклеотиды и специальную “ДНК-заплатку” (фрагмент ДНК, выступающий в качестве шаблона в процессе зашивания) — как правило в каждой лаборатории делают самостоятельно», — продолжает объяснять Ребриков.
Мутация, которую вносили в эмбрионы, также не является совершенно новой. Более того, она не является и искусственной — около одного процента жителей Европе врожденным образом устойчивы к ВИЧ, то есть несут два аллеля этого мутантного гена, а 10 процентов несут один аллель.
«Эта модификация соответствует присутствующему в популяции варианту гена, который представляет собой возникший в процессе эволюции аллель, вариант гена без 32 букв. И в этом есть некое этическое облегчение ситуации, потому что мы не говорим, что мы создали новый аллель, новый вариант гена, который не встречается у людей. Тысячи людей совершенно естественным путем родились и живут именно с таким вариантом гена», — подчеркивает Ребриков.
Насколько это опасно?
Методика уже опробована, но переход из лаборатории к клинической практике — совсем другое дело, и у фармацевтических компаний на это уходят годы, если не десятки лет. С чисто технической стороны дела, для обеспечения безопасности нужно быть уверенным в двух вещах: метод эффективно редактирует целевой участок ДНК, причем это происходит на статистически значимой выборке с малым процентом отказов (редактирование таргетного локуса), и при этом редактированию не подвергаются другие участки генома (нередактирование неспецифичного локуса).
«Учитывая масштабы центра, с которым работал Хэ, эту методику, скорее всего, отрабатывали три-четыре года. Набрали информацию на эмбрионах и, исходя из своих статистических данных, разрешили себе поставить подобного рода эксперимент», — предполагает Волчков.
Сама по себе генетическая терапия ВИЧ — тоже не абсолютная новость. Компания Songamo тестирует этот метод для лечения вируса, но только на соматических, «обычных» клетках, а не стволовых клетках эмбрионов. Дело дошло до клинических испытаний, а это значит, что по проблеме накоплено очень много данных. Это и данные компании, и открытые данные в научных публикациях.
«Этот ген и система таргетирования — они хорошо изучены, китайцы не вслепую это делали, они лишь перенесли эту технологию на редактирование эмбриона, а не соматических клеток», — замечает Волчков.
Однако и он не уверен в стопроцентной правильности проделанной процедуры.
«Что бы я хотел увидеть, чтобы убедиться в корректности работы? Прежде всего, это предварительные эксперименты на клеточных линиях (эмбриональных столовых клеток). Статистически значимое количество экспериментов на эмбрионах с прерванным развитием — допустим, 25-50 случаев, где четко показывается, что редактируется таргетный ген и отсутствует или почти отсутствует неспецифическое таргетирование других аллелей, которые могли бы дать негативный вклад в состояние будущего человека. Лишь после этого можно было бы переходить к следующей фазе», — говорит Волчков.
Но, по его словам, тут возникает вопрос о правовом регулировании подобных экспериментов. «Только регулятор, в данном случае китайский аналог FDA, может установить критерий этого „почти отсутствует“. Пока нет критерия, сложно рассуждать, что допустимо, а что недопустимо», — рассуждает ученый.
«Но представим, что этот этап пройден. Дальше я бы хотел видеть испытания на животной модели. Самая близкородственная человеку модель — это человекообразная обезьяна. Если бы генетическое редактирование продемонстрировали сначала на них, а не на человеческих близнецах, это было бы более правильно, — продолжает Волчков. — Тем более, что работы в этой области уже ведутся: в этом году у китайских же ученых вышла статья в Nature о том, что они клонировали макаку (нечеловекообразную обезьяну), и еще одна — о том, что они отредактировали ее геном».
А вот Хэ и его группа, по-видимому, не хотят тратить время на опыты над обезьянами. «То, что они пропустили эту важную стадию и перешли к экспериментам на людях, говорит не в их пользу», — заключает Волчков.
Вместе с тем, эмбриогенез человека — это высоко саморегулирующаяся система, и если в ней что-то идет не так, то эмбриональное развитие терминируется (происходит выкидыш на той или иной стадии беременности). Впрочем, этот механизм, к сожалению, работает не всегда, замечает ученый. Но если положиться на высокую вероятность его работы, это значит, что сам факт появления девочек на свет подтверждает неповрежденность их генома.
Профессор Сколтеха и университета Ратгерса Константин Северинов отмечает, что выводы о безопасности, строго говоря, можно будет делать, только доведя эксперимент до логического конца: после генетической манипуляции с яйцеклеткой должен родиться ребенок, повзрослеть, произвести на свет собственных детей, прожить более или менее нормальную жизнь. «Так было с овечкой Долли. Успех эксперимента с ней, в частности, заключался в том, что она произвела на свет еще одну овечку. Но у людей срок жизни сравним со сроком жизни исследователей. В этом смысле очень сложно поставить эксперимент, чтобы он соответствовал тому уровню доказательности, который хочется иметь перед тем, как использовать процедуру», — сказал ученый.
Что именно сделано
28 ноября Цзянькуй Хэ выступил с докладом на GeneEdit Summit в Гонконге, где извинился за досрочную «утечку информации» и рассказал про технические детали своей работы (транскрипт доклада и слайды презентации посетители конференции выложили в Твиттере).
Итак, целью работы было внесение в жизнеспособные человеческие эмбрионы природной мутации CCR5-delta32, то есть делеции в 32 нуклеотида, которая нарушает работу гена и защищает ее носителей от заражения ВИЧ.
По словам Хэ, прежде чем редактировать человеческие эмбрионы для трансплантации, они тщательно подобрали направляющую РНК и проверили ее на нежизнеспособных эмбрионах и эмбриональных клеточных линиях. Кроме того, используя подобранную «затравку», сотрудники Хэ вырастили макаку с нужной мутацией в геноме.
Самой важной частью доклада Хэ стал анализ ДНК отредактированных близняшек. После рождения из пуповинной крови девочек выделили ДНК и полностью отсеквенировали их геномы. Кроме того, ДНК была выделена из нескольких других тканей. В результате секвенирования нецелевой активности Cas9 обнаружено не было.
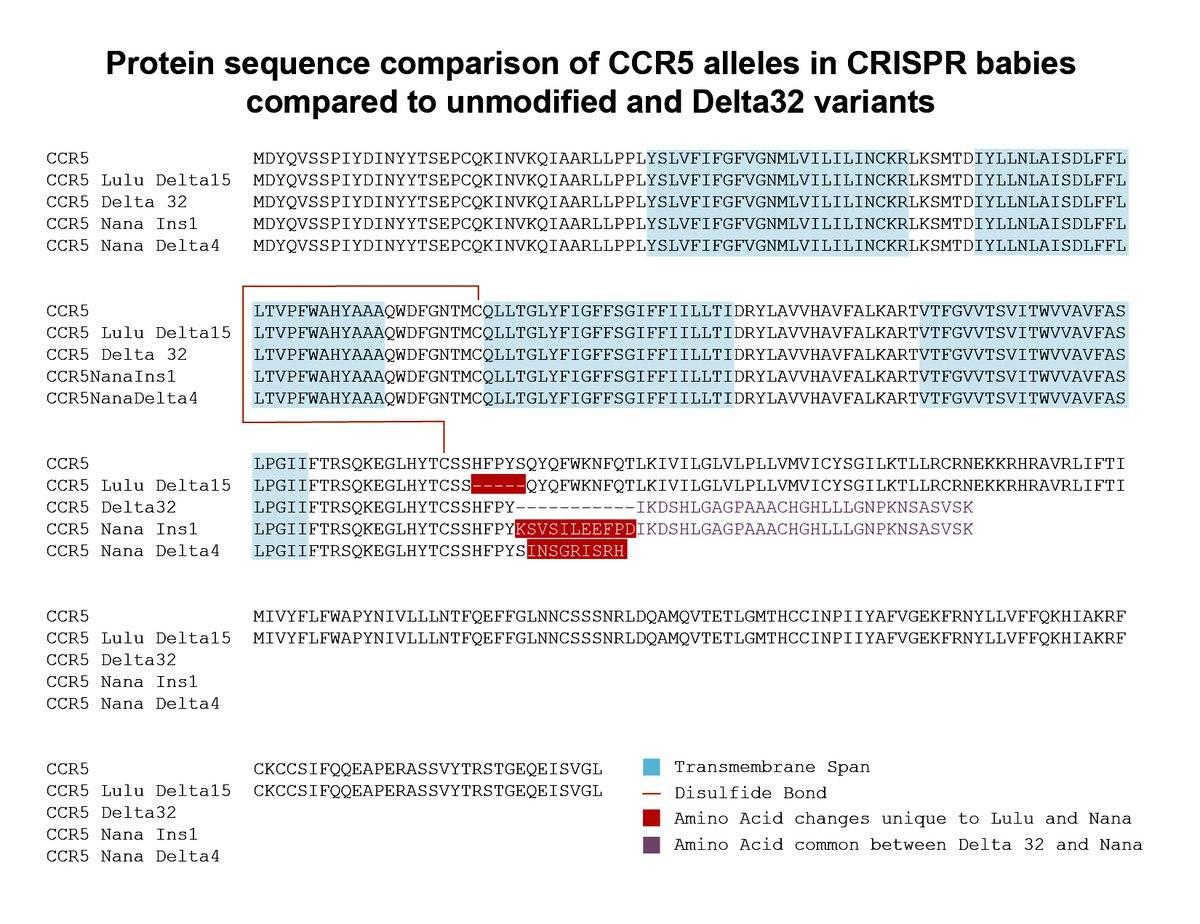
Была ли достигнута заявленная цель? Последовательности белка CCR5 у обеих девочек действительно не совпадают с белком «дикого типа». Однако, судя по всему, нужной мутации (дельта-32) у них тоже нет. На представленном слайде видно, что у одной из девочек в одной копии гена появилась делеция в 15 нуклеотидов, то есть в пять аминокислот, а другая копия осталась нетронутой. Таким образом, белок CCR5 лишился небольшого кусочка, но все еще может быть функциональным.
У ее сестры оказались затронуты обе копии гена — в одной из них небольшая делеция в четыре нуклеотида, а в другой однонуклеотидная вставка. Белок в обоих случаях будет укороченным, но как это повлияет на устойчивость к вирусу, непонятно.
Последовательности CCR5 девочек указывают на то, что редактирование достигло цели лишь частично — направляющая РНК сработала, белок Cas9 внес разрез, но клеточные системы репарации, вместо того чтобы воспользоваться нужной «заплаткой», залечили разрез без всякого разбора. Кроме того, обе девочки, судя по всему, получились «мозаиками», то есть некоторая часть клеток у них осталась неотредактированной.
С этими проблемами ученые сталкивались во всех опубликованных статьях, посвященных редактированию человеческих эмбрионов, и результат первого эксперимента на людях подтверждает: как бы ни было интересно проверить прорывную технологию «в бою», для свершения революции она все же еще недостаточно отработана.
А это этично?
Эксперты считают, что нет. Причем сразу по нескольким причинам.
По словам доцента кафедры культурологии и социальной коммуникации Российской академии народного хозяйства и государственной службы (РАНХиГС) Оксаны Мороз, существуют два подхода, обосновывающие моральность тех или иных поступков, — деонтология и консеквенциализм.
«Деонтология предлагает принимать решение о моральности на основе принятых в обществе правил. Если мы следуем правилам, это морально, если нет — то нет. Вся история о том, что экспериментировать с эмбрионами до семи дней — это этично, а после — неэтично, потому что после идет прикрепление эмбриона к матке, это чисто деонтологический подход. Консеквенциализм проводит оценку моральности действия через его результат. Если последствия хорошие — значит, это хорошо. И именно к этому подходу апеллирует китайский ученый. Неважно, как бы говорит он, что я исходил из моральных предпосылок, принимаемых не всеми. Важно, что последствия моих действий будут замечательные», — поясняет рамку обсуждения Оксана Мороз.
Но вопрос о глобальных последствиях в данном случае выходит за рамки беспокойства о здоровье конкретных людей. Речь идет о целостности генетической базы человеческой популяции, отмечает ученый.
«Когда мы редактируем геном и как бы конструируем нового человека, мы не можем быть уверены, что отредактировали именно то, что нуждалось в ремонте, и не повредили чего-то другого, важного в долгосрочной перспективе. На первый взгляд, вреда от таких манипуляций вроде бы нет, но, поскольку лонгитьюдные данные отсутствуют, мы не можем судить, насколько наше вмешательство в геном помогает только лишь излечивать и не наносит никакой отложенный вред. Ведь в будущем эти генетически модифицированные люди попадут в объем генетического материала человечества, сами станут родителями. И не исключено, что наше вторжение в общее генетическое пространство может иметь отложенный эффект», — отмечает Мороз.
Кроме того, есть еще вопрос об информированном согласии родителей. Сам Хэ уже заявил, что люди, которых он подверг этому эксперименту (родители близняшек), знали, на что идут. Но и на этот счет есть сомнения. «На бумаге у него зафиксировано, что он проводит эксперимент по терапии ВИЧ, и только в устном порядке он сказал родителям, что именно планирует делать. И большой вопрос, насколько люди, далекие от генетики, могли понять суть его действий», — говорит ученый.
Беспокойство вызывает и потенциальная проблема элитизма.
«Мы можем исходить из того, что мы вылечим всех — еще на стадии эмбрионального развития, когда будущие люди еще ничего не чувствуют и не страдают. Но если наша технология будет внедрена и выпущена на рынок, то, скорее всего, она будет доступна не всем. И тогда в обществе появятся некие X-men, возникнет новый тип неравенства — не социального и не физиологического, доставшегося от рождения, а неравенство на основе искусственно сделанной физиологии, — рассуждает Оксана Мороз. — И не очень понятно, как мы будем с этим справляться, ведь мы уже сейчас с трудом справляемся с тем, что есть гендерное разнообразие и третий пол. Насколько общество готово к появлению персонажей с особенностями такого типа?»
Наконец, это эксперимент на людях.
«Ученый хочет похвалы, но не думает о том, что в результате его действий на свет появятся живые люди, которые будут думать, и чувствовать, и понимать, что они родились в результате эксперимента. Это история про чудищ Франкенштейна, которые создаются, а потом мучаются тем, что они плод гордыни человеской. Тут переплетаются религиозные и нравственные факторы, которые ставят под вопрос легитимность таких действий. Не случайно китайские институции дистанцировались от этой работы», — отмечает эксперт.
Впрочем, Денис Ребриков из РНИМУ говорит, что о проблеме появления в результате генетического редактирования «сверхлюдей» думать еще рано. Пока во всех случаях генетическая модификация эмбрионов ограничивалась только теми генетическими вариантами, которые уже есть в популяции. «Мы знаем, что есть люди с делецией в гене CCR5, их довольно много в Северной Европе, что это не та мутация, которая влечет за собой тяжелые последствия. Никто пока не собирается вставлять в человеческий геном какие-то буквы, которых в нем не бывает», — пояснил он.
Ребриков подчеркивает, что в подобных экспериментах должно проводиться секвенирование геномов обоих родителей и генома получившегося эмбриона до его переноса будущей матери. В этом случае можно быть уверенным, что были изменены только запланированные участки ДНК и никакие другие генетические изменения не произошли.
Это запрещено?
Здесь мы переходим к деонтологическому подходу обеспечения моральности.
«Речь идет о сфере со слабо развитым правовым регулированием. Оно аккумулируется вокруг запретов и ограничений, однако нормы процедурного характера, позволяющие позитивно решать те или иные вопросы, минимальны», — считает Пауль Калиниченко из МГЮА.
Именно поэтому такие эксперименты в большей степени возможны в странах Юго-Восточной Азии, где регулирование в этой сфере слабее, чем в Европе или в США. В Европе этические барьеры глубоко внедрены в правовую практику, поэтому рассматриваемый кейс попадает в более широкую категорию — «опыты над людьми». Они категорически запрещены, и это исторически предопределено. «В Европе это относится к евгеническим исследованиям, а в ЕС евгеника запрещена вообще, даже позитивная евгеника. Поэтому там такие работы невозможны», — заключает эксперт.
Особняком в этом ряду стоит Великобритания. Там работы по редактированию генома эмбрионов были разрешены в 2016 году вслед за Китаем — конечно, под надзором этических и исследовательских комиссий.
«В США ситуация помягче, но и она не говорит о том, что американцы прямо сейчас могут позволить себе подобные эксперименты. Там закон разнится от штата к штату, и все равно правовое регулирование до конца не сложилось. Кроме того, американский подход — он, скажем так, практикоориентированный. Некий пробел в законодательстве закладывается специально, чтобы не препятствовать работе индустрии там, где есть коммерческий потенциал. Полноценное регулирование отложено на потом: если что-то пойдет не так, то они этим займутся. А пока все безобидно, пусть развивается», — поясняет Калиниченко.
Этот подход можно усмотреть и в нормах регулирования работ с эмбриональными стволовыми клетками: ограничения распространяются только на исследования, получающие федеральное финансирование.
«Китай — государство неправовое, поэтому смысл и цели политики государства понять до конца невозможно. Она утилитарна по своим целям и задачам, то есть подчиняется задачам КПК. Но что важно — китайские власти поддерживают научные исследования, выделяют гигантские деньги, чтобы перекупить ученых, создать условия для их деятельности. Видимо, для них важен результат и этим может объясняться некая либеральность законодательства. То есть те послабления, которые делают китайцы, служат целям науки, а не бизнеса. Если дело дойдет до клинической практики, либерализация законов может быстро смениться жестким регулированием», — отмечает ученый.
В России же регулирование в этой области спущено на локальный уровень. Многое здесь определяется на основании существующей практики и норм конкретных учреждений, не подчиняется никаким жестким циркулярам. Оценить, хорошо это или плохо, эксперт не берется, но призывает к усовершенствованию российской правовой действительности на основе объективного анализа потребностей, в том числе, научной работы.
Скоро ли подобные операции станут обыденными?
Судя по всему, не так и важно, родились ли генетически отредактированные младенцы именно сейчас. Если этого еще и не произошло, то может произойти в любой момент, причем произойдет обязательно.
«То, что это будет сделано, — лишь вопрос времени. Будет ли это Хэ или кто-то другой, неважно. Есть такое выражение: it’s not a question of if, but when, — „вопрос не в том, случится ли это, вопрос в том, когда это произойдет“. Я думаю, человеку, который это сделает первым и добьется успеха, поначалу придется очень трудно. Но потом его будут носить на руках», — заключает Константин Северинов.
Авторы: Александра Борисова, Дарья Спасская