Группа исследователей разработала метод производства функционирующих человеческих кровеносных сосудов и продемонстрировала, что эти сосуды могут переносить кровь и питать ею выращенные в лабораторных условиях модельные органы и опухоли.
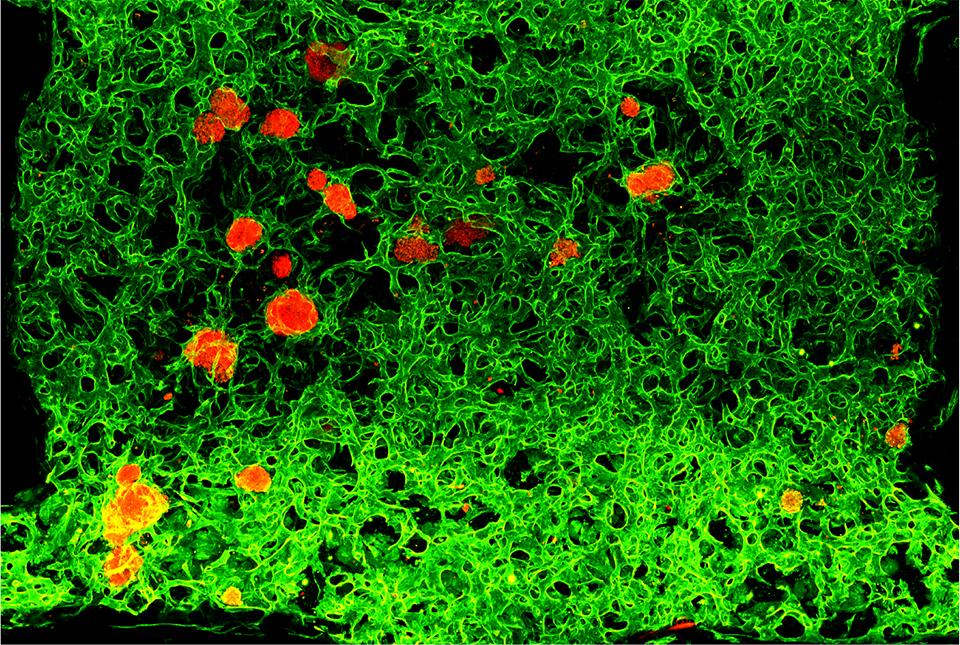
В основе метода, описанного в опубликованной 9 сентября в Nature работе, — открытый недавно белок, способный омолаживать клетки сосудистого эндотелия, возвращая их в пластичное состояние, в котором они легко растут и адаптируются к окружающим тканям.
Точность моделирования человеческих болезней на животных оставляет желать лучшего. Это усложняет разработку терапевтических средств и методов восстановления повреждённых органов или их замены искусственно выращенными. При этом донорских органов всегда не хватает. А иногда пересаженные органы выходят из строя из-за плохого кровоснабжения. Кроме того, и органы, и опухоли бывают разные — и сосуды в них тоже разные и по-разному работают. Поэтому успех в деле восстановления и выращивания органов, а также в нацеливании терапии на конкретный тип опухоли, зависит от того, насколько хорошо мы понимаем, какими именно свойствами должны обладать искусственные сосуды, и насколько хорошо можем их «настроить», чтобы они были похожи по свойствам на настоящие и могли правильно работать в конкретном органе.
Используемые сейчас модели типа «орган-на-чипе» состоят, как правило, из микроконтейнеров и микроканалов: в контейнерах размещается культуры клеток органа или опухоли, по каналам подаются и отводятся необходимые для их функционирования жидкости. Микроканалы при этом вполне могут быть выстланы эндотелиальными клетками и в какой-то степени имитировать кровеносные сосуды. Но у таких устройств есть множество ограничений: чрезвычайно малый объём, отсутствие клеточной свободы, отделённость эндотелиальных клеток от паренхиматозных (основных функциональных клеток органов) или опухолевых полупроницаемыми материалами и т.п. В рамках этой технологии сосуды не имеют возможности развиваться и приспосабливаться к другим тканям.
Текущее исследование основано на открытии первой авторки, доктора Бризы Паликуки (Brisa Palikuqi) из Калифорнийского университета в Сан-Франциско (University of California, San-Francisco). Она выяснила, что белок под названием ETV2 способен значительно изменять свойства клеток сосудов взрослого человека, выращенных в культуре. ETV2 — это «новаторский транскрипционный фактор», способный перепрограммировать клетки, включая или выключая широкий набора генов.
«Зрелые клетки эндотелия не могут образовывать новые кровеносные сосуды с нуля, — говорит Паликуки. — Наша идея заключалась в том, чтобы использовать ETV2 для возврата клеток эндотелия к молодому состоянию, в котором они могут формировать новые сосуды на основе сигналов, поступающих от окружающих тканей. Таким образом, они встраиваются в окружающие ткани и обучаются выполнять специализированные функции. Мы также выявили, что смесь из трёх тканеобразующих «матричных» белков помогла омоложенным клеткам эндотелия (R-VEC) формировать сосуды в устройствах, оперирующих телесными жидкостями, в частности, кровью. У нас получилась трёхмерная платформа, мы её назвали «Орган-на-сосудистой-сети». Мы можем использовать R-VEC для создания тканеспецифичных кровеносных сосудов, которые могут помочь в деле регенерации разных органов».
Новые искусственные сосуды легко адаптировались к кровеносной системе мышей и оставались жизнеспособными в течение нескольких месяцев. Также сосуды R-VEC поддерживали рост лабораторных здоровых или раковых органоидов (органов, выращенных в искусственных условиях). R-VEC открывает широкие перспективы для регенеративной медицины и борьбы с онкозаболеваниями. Теперь есть возможность создавать модели с тканями, хорошо оснащёнными сосудами. Это позволит точно имитировать человеческие болезни и избавит исследователей от необходимости прибегать к животным моделям.
Чтобы продемонстрировать универсальность разработанной технологии, команда показала, что в лабораторных условиях R-VEC способны обеспечить кровеносными сосудами (васкуляризировать) и поддерживать функциональность кластеров островковых клеток человека — островков Лангерганса, которые производят инсулин в поджелудочной железе и повреждаются аутоиммунным ответом при сахарном диабете 1-го типа. Пересадку островков иногда делают в ходе лечения диабета, но если их пересаживать в легкодоступные места, такие как кожа, они не могут развить там надёжной системы сосудов. Поэтому приходится их пересаживать в печень, и это затрудняет мониторинг трансплантата.
«Способность R-VEC к васкуляризации человеческих островков Лангерганса заложит основу для создания долговечных островков для потенциального лечения диабета I типа, — объясняет соавтор статьи доктор Джо Чжоу (Joe Zhou). — Такие васкуляризированные островки были бы более доступными, имели бы лучшую выживаемость и превосходили бы методы лечения, доступные в рамках существующих сегодня технологий. Они также открыли бы новые возможности для тестирования лекарств, направленных на остановку аутоиммунной реакции».
Сети сосудов R-VEC уже используются для изучения заболеваний человека. «Мы используем сосудистую сеть R-VEC для изучения того, как именно вирус SARS-CoV-2 наносит ущерб малым кровеносным сосудам внутри органов. Это создаёт условия для разработки новых способов лечения», — рассказал доктор Роберт Шварц (Robert Schwartz), доцент кафедры гастроэнтерологии в Weill Cornell Medicine.
«Открывается новый рубеж в регенеративной медицине, так как некоторые из основных препятствий, стоящих перед этой отраслью, теперь будут преодолены», — добавил доктор Шанин Рафии (Shahin Rafii), профессор медицинской генетики и руководитель отделения регенеративной медицины в Weill Cornell Medicine.
Подготовка материала: Мария Толмачёва