Из бактериального оружия можно сделать биотехнологический инструмент для высокоточной доставки молекулярных грузов.
Эффективному лекарству нужна эффективная доставка. Пусть у нас есть молекула, истребляющая буквально все раковые клетки, которые встретятся на её пути — нужно ещё сделать так, чтобы эта молекула до них добралась. А если наше лекарство бьёт не только по злокачественным клеткам, но и по здоровым тканям, то тем более нужна точность в выборе мишени: лекарственное вещество должно попасть строго по адресу и никуда больше. И дело не только в злокачественных болезнях. Есть ещё масса медицинских задач, которые требуют адресной доставки чего-нибудь куда-нибудь. И в фундаментальной науке такое тоже нужно — когда мы прямо в организме хотим в исследовательских целях подействовать на строго определённый тип клеток.
Проблему адресной доставки решают по-разному. Часто мы слышим, например, о наночастицах, которые прилипают к одним клеткам и не прилипают к другим. Или же используют антитела, которые должны связываться с определёнными поверхностными белками. Разные клетки отличаются молекулярным портретом на наружной мембране, и вот антитела можно настроить на то, чтобы они садились на клетки конкретного типа. При этом антитело можно соединить с лекарством, и лекарство придёт именно туда, куда нужно.
Сотрудники Массачусетского технологического института выбрали другой подход. Они работали с бактериальными шприцами — сложными белковыми структурами, с помощью которых бактерии вводят в другие клетки различные молекулы (например, ферменты, которые помогают им расщеплять белки в клетке-мишени, или молекулы-сигналы, определённым образом влияющие на внутриклеточные процессы). Эти бактериальные структуры относятся к так называемым системам секреции, и многие из них действительно работают как шприцы. В них есть полая трубка, которая протыкает клеточную мембрану и по которой в клетку поступают ферменты, токсины и пр., и есть сократительный аппарат, который толкает трубку в мембрану. И трубка, и сократительный аппарат состоят из белков. Кроме того, у некоторых бактерий молекулярный шприц снабжён своеобразными «ножками» — фибриллами, которые помогают зафиксировать всю конструкцию на клетке-мишени. Есть бактерии, которые держат шприц при себе, но есть и другие, которые отправляют шприц вместе со всем его содержимым во внешнюю среду: он сам найдёт клетку и сам сделает всё необходимое.
Исследователи работали именно с таким автономным шприцом, которым пользуются бактерии рода Photorhabdus. Они живут в симбиозе с паразитическими червями нематодами, которые специализируются на насекомых: бактерии разрушают ткани насекомых, помогая нематодам их есть. Клетки насекомых бактерии Photorhabdus убивают с помощью молекулярного шприца, однако их шприц способен связываться не только с клетками насекомых, но и в какой-то мере с клетками мышей. Раз контактный белок бактериального шприца может связываться с клетками мышей, его, вероятно, можно переделать так, чтобы он связывался с клетками человека.
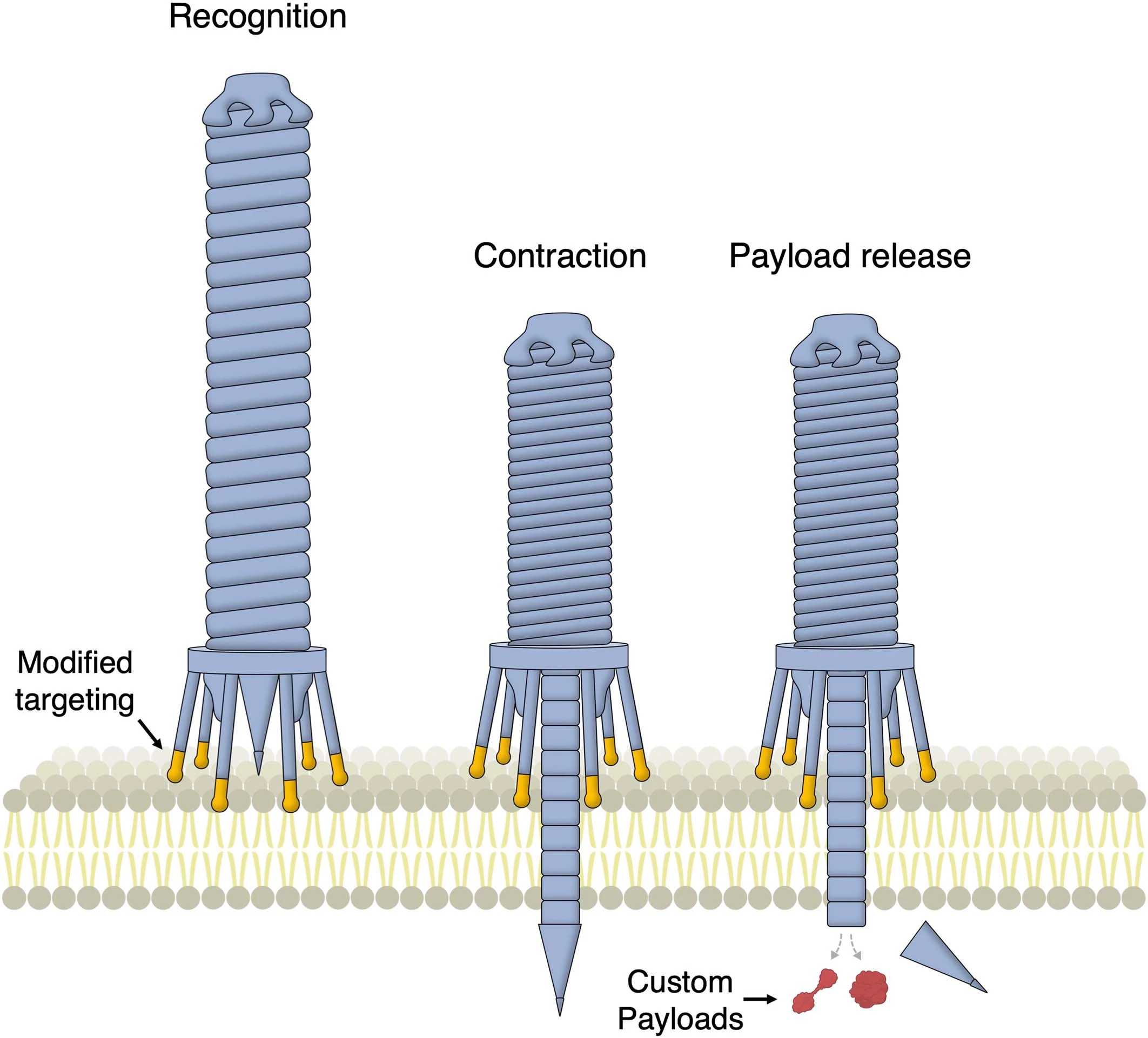
С помощью алгоритмов искусственного интеллекта контактный белок модифицировали так, чтобы к нему по желанию можно было легко пришивать куски, нацеливающие его на разные клеточные рецепторы. Но шприц ещё нужно чем-то заполнить. Он распознаёт определённые последовательности в белках, которые предназначены для транспортировки, и всасывает их в себя. Эти последовательности можно сравнить с товарными накладными, и их опять же легко можно пришить к тому белку, который мы хотим ввести с помощью шприца. В статье в Nature говорится, что шприц, нацеленный на определённый рецептор на раковых клетках человека и несущий в себе токсин с «накладной», полностью убивал все клетки с таким рецептором – и абсолютно не трогал другие, у которых рецептора не было.
В другом эксперименте молекулярный шприц отправляли мышам в мозг – он должен был ввести в нейроны флуоресцентную краску. Нейроны засветились только вокруг того места, куда вводили молекулы – точнее, молекулярные комплексы – шприца. То есть он эффективно и специфично связывался с теми клетками, с которыми должен был, и не распространялся по всему мозгу. Попутно исследователи отмечают, что шприц не вызвал в мозге особого иммунного возмущения.
Главный плюс здесь в том, что это не уникальный доставщик, созданный строго под определённую мишень и определённый груз – для разных мишеней достаточно заменить в нём некоторые детали, а груз снабдить нужной маркировкой. Говоря языком маркетинга, молекулярный шприц легко поддаётся кастомизации. Исследователи даже сумели с помощью него ввести в клетки запчасти для генетического редактора CRISPR/Cas9 – будучи доставлен по адресу, он начал редактировать клеточный геном. И хотя пока неясно, насколько бактериальный шприц пригодится в клинической медицине, в лабораторных экспериментах его наверняка ждёт большое будущее.
Автор: Кирилл Стасевич
