Американские исследователи разработали маскирующую систему для бактерий, позволяющую им временно скрываться от иммунной системы человека. Бактерии, покрытые особой оболочкой, способны находить раковые опухоли и, размножаясь в них, производить противоопухолевые токсины.
Использование бактерий для терапии — новый, альтернативный и во многом спорный подход к лечению широкого спектра видов рака. Одна из наиболее очевидных проблем этого метода лечения — токсичность бактерий-доставщиков для организма человека. В отличие от многих традиционных способов целевой доставки лекарств, бактерии продолжают жить и размножаться в организме пациента.
Иммунная система человека распознает бактерии как чужеродные и опасные, что вызывает воспалительную реакцию. Эту проблему решают либо генной инженерией бактерий для зачистки поверхности микроорганизмов от антигенов, на которые реагирует иммунная система, либо покрытием поверхности живых доставщиков лекарств в специальную молекулярную защиту.
Первый способ ослабляет бактерии: они плохо размножаются и быстро погибают, так и не доставив лекарства. Второй способен дать микроорганизмам слишком много времени для размножения, что приведет к неконтролируемому росту и из-за чего может начаться сильная воспалительная реакция.
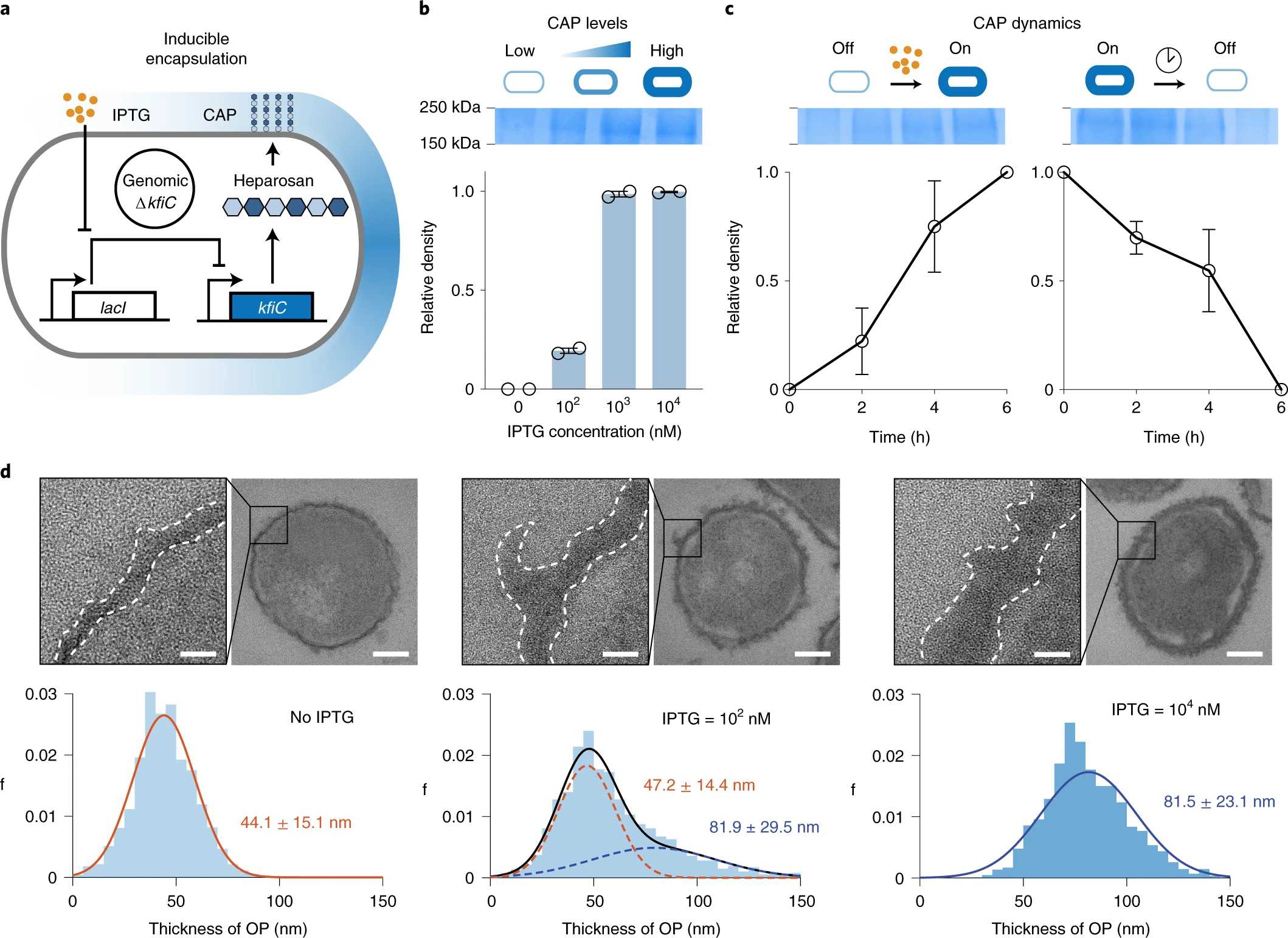
Поэтому в новом исследовании, результаты которого опубликованы в журнале Nature Biotechnology, американские биотехнологи сосредоточились на генной инженерии и управляемом биосинтезе молекулярной защиты в бактериях Escherichia coli Nissle 1917. Они использовали синтезируемый самими бактериями капсульный полисахарид (CAP), покрывающий их поверхность и защищающий от обнаружения иммунной системой человека, и нашли способ контролировать его производство.
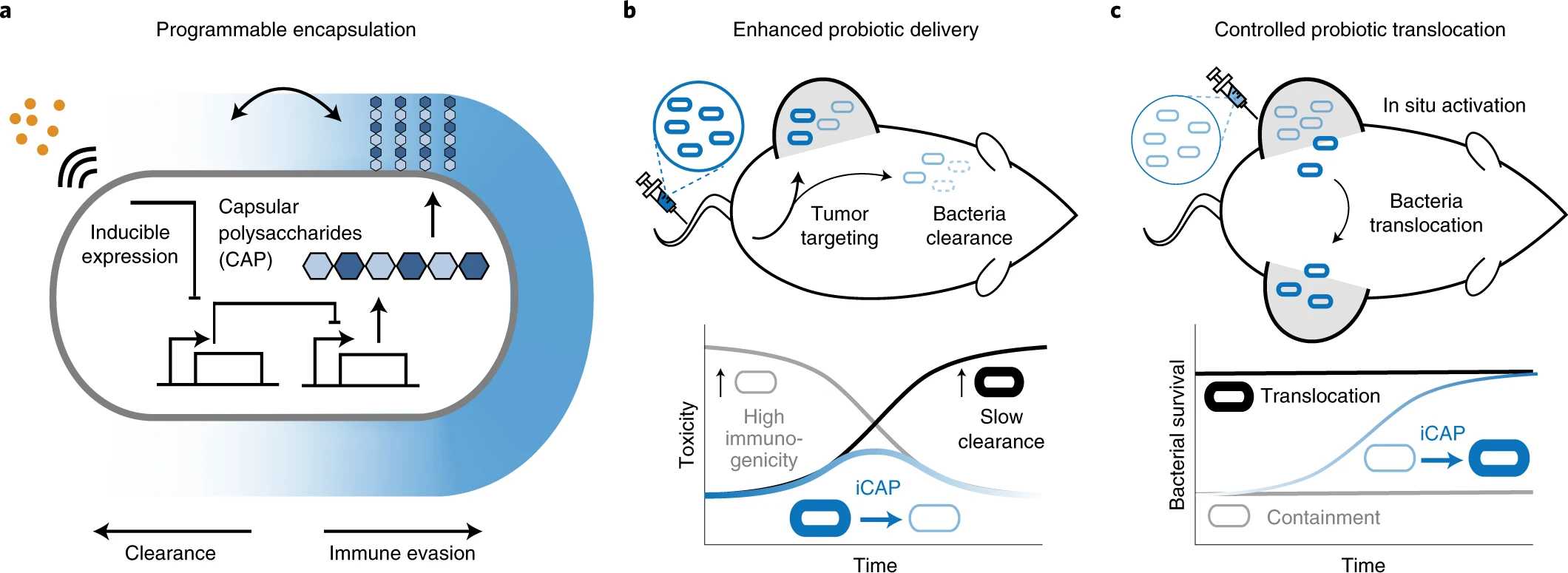
«Мы взломали систему CAP пробиотического штамма E. coli Nissle 1917, — поясняет Тецухиро Харимото (Tetsuhiro Harimoto), аспирант кафедры биомедицинской инженерии в Колумбийском университете (США) и соавтор исследования. — С CAP эти бактерии могут временно уклоняться от иммунной атаки; без CAP они теряют свою защиту и могут выводиться из организма. Поэтому мы решили попытаться создать эффективный выключатель».
Для этого исследователи разработали систему iCAP (индуцибельный CAP). Они контролируют систему iCAP, используя внешний сигнал — небольшую молекулу, называемую IPTG (изопропил-b-D-тиогалактопиранозид). В присутствии IPTG бактерия синтезирует CAP и создает себе плащ-невидимку, скрывающий ее от иммунной системы. Если эту молекулу убрать, то в течение шести часов защитный покров с бактерий полностью спадет.
«Что действительно интересно в нашей работе, так это то, что мы можем динамически управлять системой, — комментирует Тал Данино (Tal Danino), доцент кафедры биомедицинской инженерии Колумбийского университета и один из научных руководителей исследования. — Мы способны регулировать время, в течение которого бактерии выживают в крови человека, и увеличивать максимально переносимую дозу бактерий. Мы также показали, что наша система открывает новую стратегию доставки бактерий, в которой можно вводить бактерии в одну известную опухоль и заставлять их контролируемо мигрировать в отдаленные опухоли, такие как метастазы — раковые клетки, которые распространяются в другие части тела».
Проверку эффективности системы iCAP проводили на мышах, больных раком. Исследователи добавили в E. coli с системой iCAP возможность производства противоопухолевого токсина и смогли уменьшить рост опухоли в моделях рака кишечника и рака молочной железы у грызунов. Причем результаты для E. coli с системой iCAP были значительно лучше, чем без нее.
Команда также продемонстрировала контролируемую миграцию бактерий в организме к опухолевым метастазам. Они вводили E. coli с системой iCAP в одну опухоль, давали мышам воду, содержащую IPTG, чем активировали CAP защиту. После этого наблюдали, как iCAP E. coli выходят из первоначальной опухоли и мигрируют в неинъецированные опухоли.
В дальнейшем авторы планируют совершенствовать свою технологию, используя другие организмы, типы молекулярных покровов (наподобие CAP) и системы управления с возможностью автономной работы поверхностных свойств терапевтических бактерий. Кроме того, одна из главных и наиболее сложных будущих задач — клинические испытания системы на человеке, более чувствительном к бактериальным эндотоксинам в сравнении с мышами.
Автор: Даниил Сухинов