Изучая клетки поштучно, можно увидеть, как отличаются клетки одной и той же ткани, принадлежащие разным органам.
Во всех наших клетках одни и те же гены, но мышечная клетка не похожа на клетку поджелудочной железы, которая синтезирует инсулин, а нейрон не похож на Т-лимфоцит. То есть из множества генетических программ работает та, которая нужна в конкретном органе и конкретной ткани. Долгое время особенности разных клеток изучали по тканям: есть нервная ткань, есть мышечная, есть соединительная и т. д. Но орган — это более сложная вещь, в каждом органе есть представители разных тканей. И вот тут возникает вопрос, насколько клетки, которые принадлежат одной и той же ткани, отличаются в зависимости от того, в каком органе они сидят. Например, клетки фибробласты соединительной ткани лёгких и клетки фибробласты соединительной ткани кожи — одинаково ли они работают, отличается ли в них активность генов?
Именно такие отличия ищет большой международный консорциум HCA, Human Cell Atlas, то есть Атлас Клеток Человека, объединяющий более 2300 исследователей из 83 стран. Их цель не в том, чтобы описать буквально каждую клетку в каждом органе — в этом нет смысла, поскольку органы состоят не из уникальных клеток, а из клеточных групп, которые принадлежат разным тканям и занимаются разными вещами. Но, как мы только что сказали, у клеток одной и той же ткани в разных органах будут свои особенности. И эти особенности можно увидеть в том, какие гены в них активны, а какие нет.
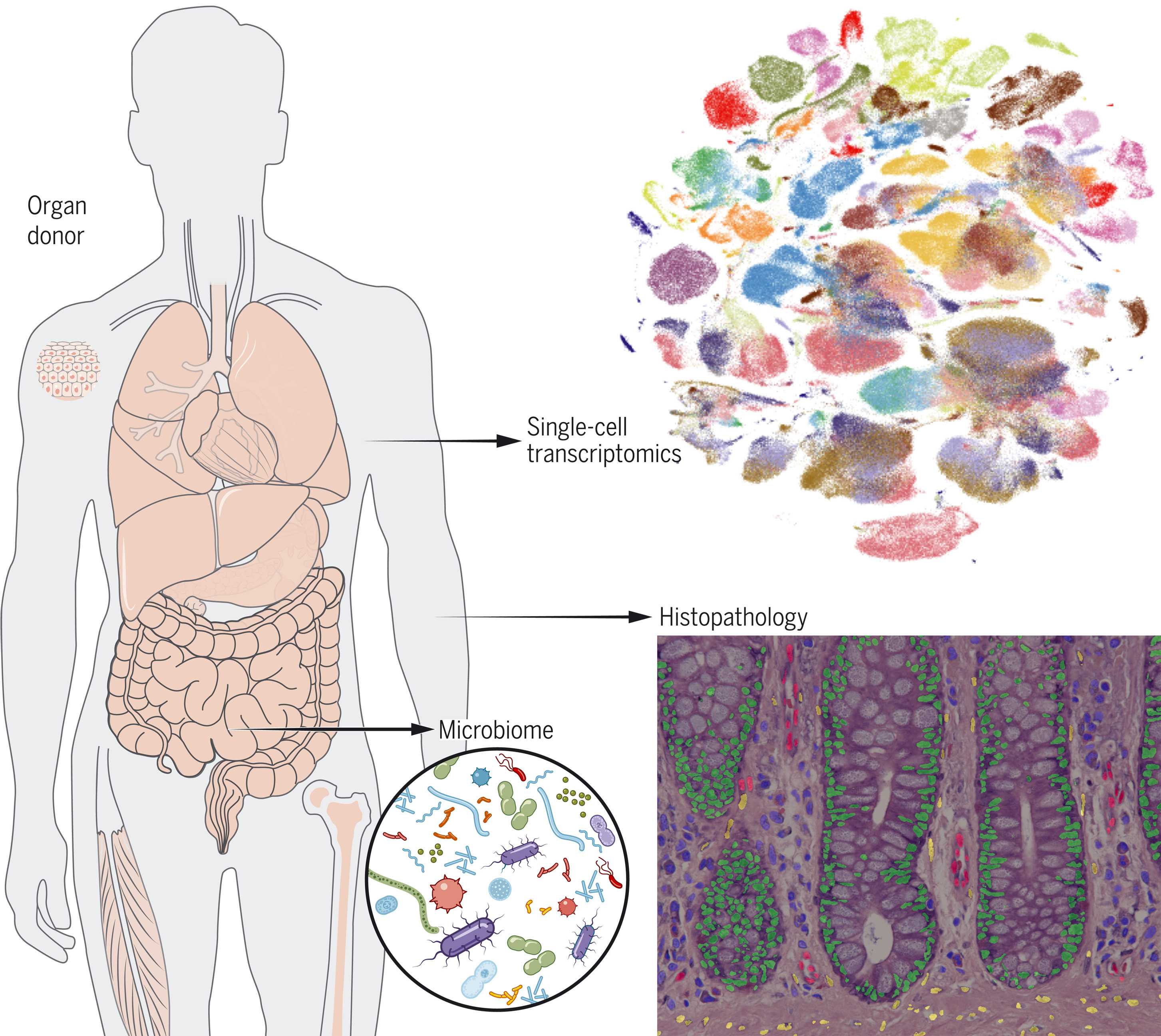
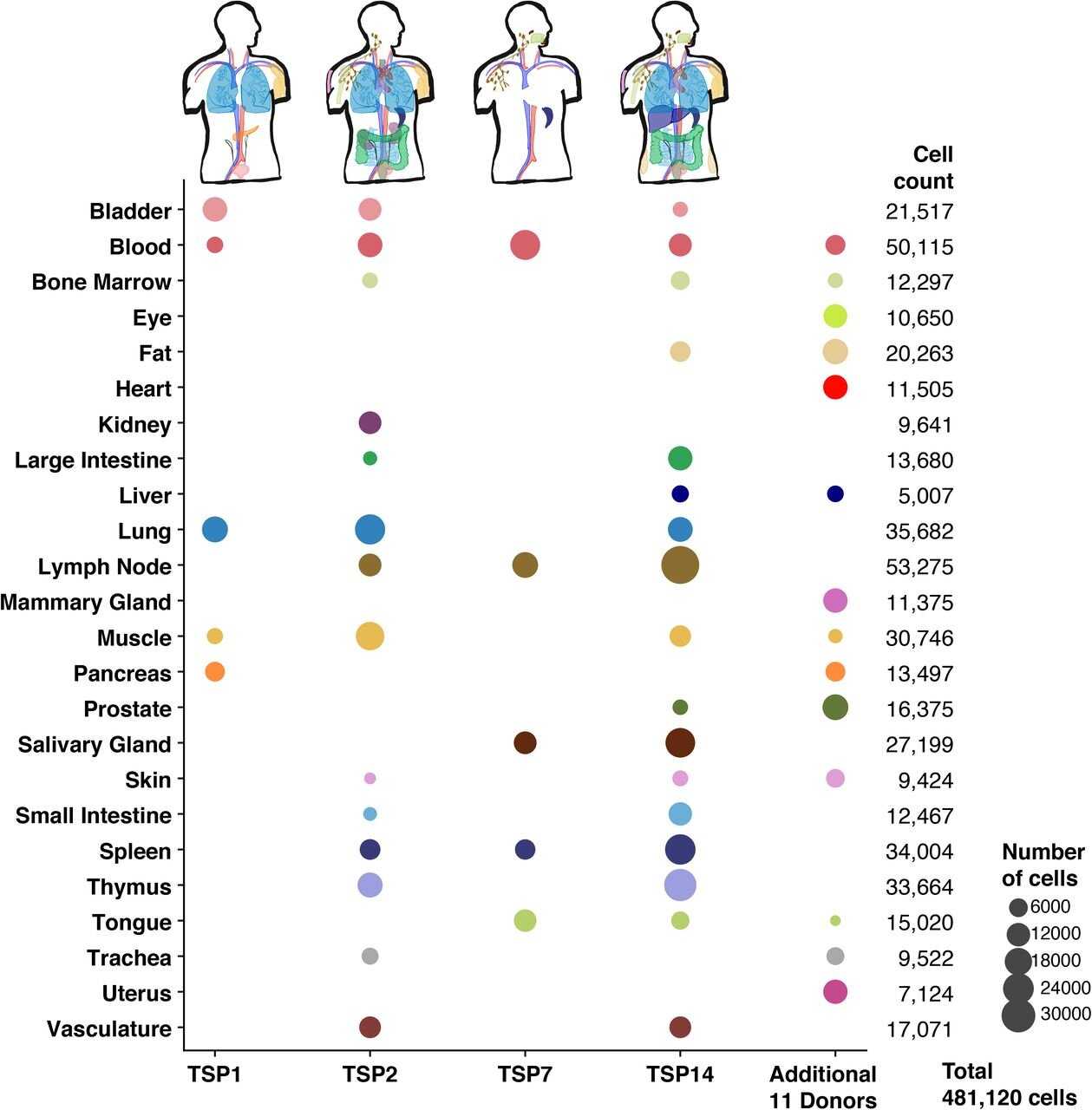
Консорциум Human Cell Atlas возник в 2016 году, и несколько лет назад уже публиковал первые результаты, касающиеся более чем полумиллиона клеток. На днях в Science вышло несколько статей, которые пополняют его ещё почти на полмиллиона. В одной из этих статей описано свыше 480 тыс. клеток из 24 органов. При анализе использовали новейшие методы, которые позволяют изучать клетки в прямом смысле поштучно: исследователи берут одну-единственную клетку и читают РНК, которая в ней есть. Читают именно РНК, потому что информация с ДНК сначала копируется в РНК, и активность гена можно оценить по количеству скопированных с него молекул РНК. Образцы органов и тканей старались брать у одного и того же человека, чтобы все клетки были идентичными. Кроме того, первые этапы анализа начинались буквально сразу, как только образцы попадали в руки исследователям, то есть без какой-либо временной консервации, без заморозки, чтобы клеточное содержимое, в первую очередь те самые РНК, не деградировали от подобных процедур.
Однако такой подход годится не для всех клеток, например, крупные клетки жировой или мышечной ткани (не говоря уже о нейронах) удержать неповреждёнными почти не удаётся. В другой статье описан альтернативный комплекс методов, который позволяет работать не со всей клеткой, а лишь с её ядром — его можно извлечь из крупной клетки целым, а из ядра потом достать РНК. Правда, тут стоит учитывать, что в ядре ситуация с РНК выглядит намного сложнее: здесь гены копируются в молекулы РНК, но потом эти РНК претерпевают некоторые превращения. Происходит то, что называется сплайсингом: куски одной и той же молекулы перестраиваются, часть из них вообще вырезается и отбрасывается, как негодные, и в итоге с одного и того же гена часто получаются несколько разных РНК. Потом, когда они выйдут в цитоплазму, на них будут синтезированы разные белки. Также это позволяет увидеть, как ещё на этапе синтеза и «перемонтирования» РНК происходит подстройка клетки под конкретные задачи. Новый метод чтения РНК из единичных ядер, кроме того, позволяет работать с замороженными тканями, и результаты оказываются вполне сопоставимыми с теми данными, которые получаются при работе с целыми незамораживаемыми клетками.
Две другие статьи говорят о разнообразии иммунных клеток, как на стадии внутриутробного развития, так и у взрослого человека. Для изучения взрослой иммунной системы образцы брали у двенадцати доноров, число же проанализированных клеток составило более 300 тыс. Как известно, кроме иммунных клеток, плавающих в крови, есть множество таких, которые сидят в различных органах, и вот именно такие и интересовали исследователей в первую очередь.
В качестве примера того, что клетки одной и той же ткани могут своеобразно вести себя в том или ином органе, можно указать на те самые фибробласты: новые данные говорят о том, что в тех фибробластах, которые сидят в лёгких, работают гены, которые обычно активны в мышечных клетках. Это не значит, что клетки соединительной ткани вдруг становятся мышечными и начинают сокращаться, но, так или иначе, им в лёгких зачем-то нужны некоторые молекулярные инструменты из мышечного арсенала. Другой пример — иммунные макрофаги, которые блуждают по тканям и в прямом смысле слова съедают всё подозрительное. Их, как оказалось, есть две группы: макрофаги сугубо иммунные, нацеленные на патогены, и макрофаги, которые поддерживают ткань в её повседневной работе, убирают разный мусор и т. д. Причём в каждой ткани доля тех и других макрофагов разная, в зависимости от того, чем эта ткань занимается.
Во многом неожиданные результаты касаются так называемых генов домашнего хозяйства — то есть таких генов, которые необходимы для базовых жизненных функций и активны в любых клетках. Оказалось, что несмотря на свою «базовость», гены домашнего хозяйства в разных клетках работают опять же по-разному — потому, что кроме домашнего хозяйства, они нужны ещё для каких-то других, «недомашних» задач.
Многие заболевания связаны с тем, что какой-то ген или группа генов перестают работать или, наоборот, начинают работать слишком активно. Но тут многое зависит от того, в каких клетках возникают генетические аномалии. Например, если речь о мерцательной аритмии, то неполадки с генами должны быть в клетках сердца — это очевидно. Однако с новым клеточным атласом мы видим, что гены, связанные с теми или иными болезнями, могут быть активны ещё и в таких клетках, про которые бы никто и не подумал. Например, гены мерцательной аритмии зачем-то нужны клеткам скелетных мышц, пищевода и предстательной железы. Какую роль они там играют, могут ли они спровоцировать там какую-нибудь патологию, и имеют ли сердечные гены, работающие в пищеводе, какое-то отношение к сердцу, пока неясно. Но, так или иначе, с помощью клеточного атласа удалось найти новые клетки для 6 тысяч «одногенных» заболеваний и для 2 тысяч сложных генетических расстройств. (Хотя, повторим ещё раз, что вовсе не обязательно новонайденные клетки играют какую-то роль в этих болезнях.)
Наконец, исследователи выяснили кое-что новое про бактерий, живущих в кишечнике — отчасти их ведь тоже можно назвать нашими клетками. Оказалось, что кишечная микрофлора неодинакова на всей поверхности кишечника, скорее, она выглядит как лоскутное одеяло, составленное из небольших бактериальных сообществ. К примеру, если на одном участке кишки каких-то бактерий больше, а каких-то меньше, то через семь с половиной сантиметров их пропорция будет уже другой. Это можно было выяснить, только взяв пробы тканей из разных зон желудочно-кишечного тракта.
Не нужно объяснять, насколько новые данные могут быть полезны для медицины: с их помощью можно лучше понять, как развиваются те или иные болезни, с их помощью можно создать новые, более эффективные лекарства, нацеленные на клетки определённой ткани с учётом их особенностей в конкретном органе. Ещё стоит заметить, что подобные исследования — характерная примета современной науки, которая может позволить себе подсчитывать клетки и молекулы поштучно.
Автор: Кирилл Стасевич