Когда в наших клетках что-то начинает идти не так, в них включается программа самоубийства. Чаще всего из таких программ мы слышим про апоптоз, однако на деле механизмов программируемой клеточной гибели насчитывают свыше десяти.
Они срабатывают в разных обстоятельствах и зависят от разных молекул-исполнителей. Но задача у них общая: клетка, у которой что-то испортилось, должна аккуратно погибнуть раньше, чем успеет навредить другим. Например, если в ее ДНК появилось слишком много мутаций, которые просто невозможно исправить, то специальные белки запустят в ней тот самый апоптоз – чтобы она из-за мутаций не превратилась в раковую.
Стоит заметить, что программы суицида включаются не только в больных клетках, но и во вполне здоровых, которые стали просто не нужны. Например, во время эмбрионального развития, когда организм формирует органы и ткани, постоянно возникает нужда убрать какую-то кучку клеток, которые уже выполнили свою функцию.
Понятно, что наше здоровье во многом зависит от того, как работают такие программы. Считается, что нейродегенеративные расстройства (такие, как болезнь Альцгеймера) и всевозможные раки развиваются не в последнюю очередь потому, что механизмы апоптоза и других видов клеточной гибели сами вышли из строя. Поэтому так необходимо понять, что включает и что отключает программы клеточного суицида и как они взаимосвязаны друг с другом.

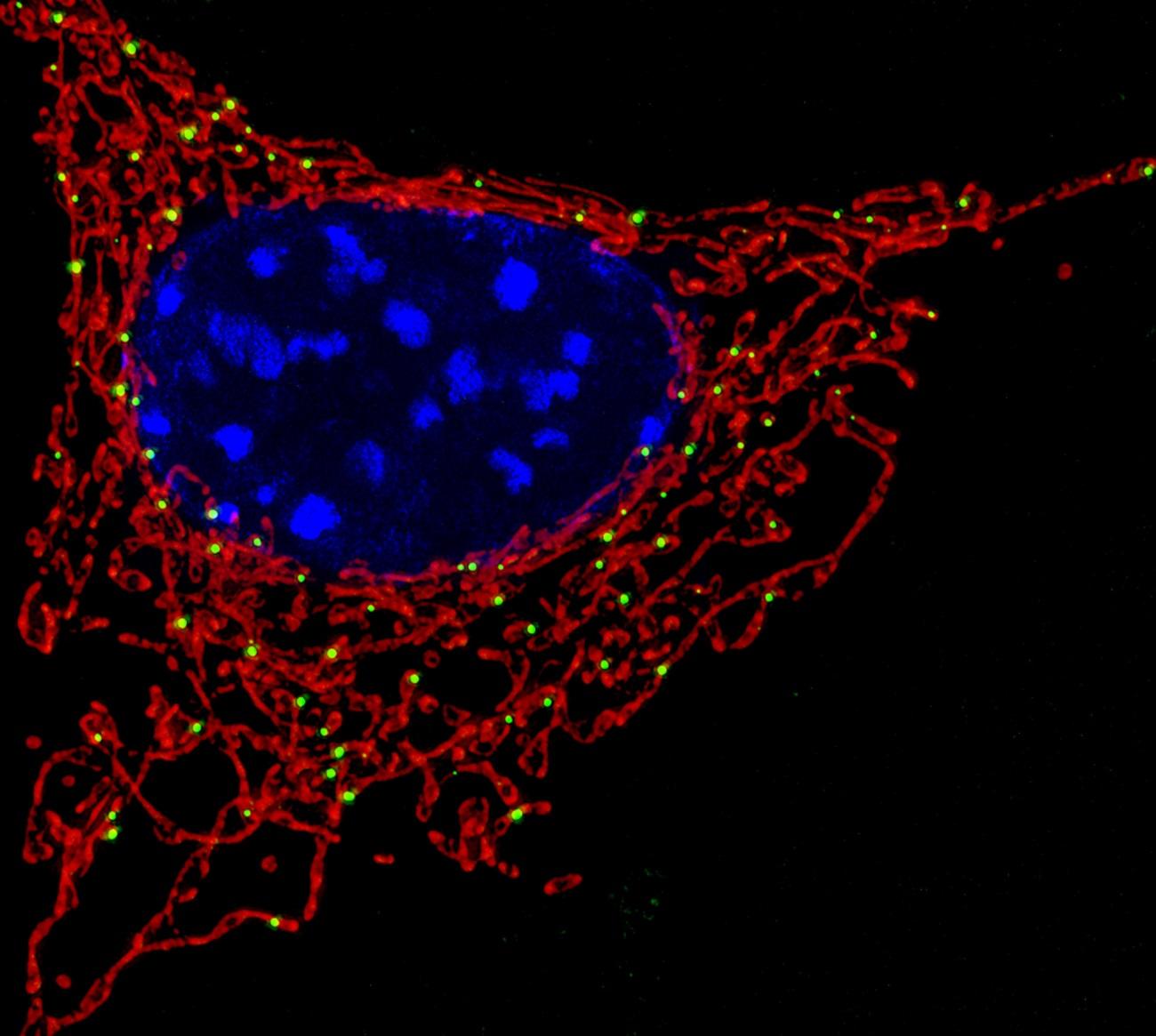
Известно, что важную роль в таких процессах играют митохондрии – клеточные органы (или органеллы), которые поставляют для клетки энергию. Митохондрии добывают энергию, окисляя разные вещества кислородом, и в качестве побочных продуктов реакции у них получаются реактивные формы кислорода – очень агрессивные молекулы-окислители. Реактивные формы кислорода легко портят биомолекулы – белки, липиды и нуклеиновые кислоты. В митохондриях есть специальные ферменты, которые их обезвреживают, однако бывает так, что система обезвреживания молекул-окислителей ломается, и митохондрия с ее «вредным производством» становится угрозой для всей клетки.
Но в таких случаях клетке вовсе не обязательно гибнуть целиком, достаточно уничтожить вышедшие из строя митохондрии. Это называется митофагией, то есть «поеданием митохондрий». Митофагия – разновидность аутофагии, или «самопоедания», фундаментального клеточного процесса, когда клетка в буквальном смысле ест саму себя. За расшифровку механизма аутофагии два года назад дали Нобелевскую премию, подробно описывать ее мы не будем, скажем только, что с помощью аутофагии клетка избавляется от внутриклеточного мусора, а также получает энергию, когда вокруг становится нечего есть.
Если клетка уничтожит испортившуюся митохондрию, то сможет нормально жить дальше. А если не уничтожит? В статье в Biological Chemistry исследователи из Московского государственного университета и Каролинского института пишут, что митофагия теснейшим образом связана с апоптозом.
В клетке можно запустить программу самоубийства с помощью препарата цисплатина, который используют для уничтожения раковых опухолей, но если в тех же клетках одновременно активировать поедание митохондрий, то апоптоз утихнет. Если же, наоборот, запретить клетке поедать митохондрии, то клетка, будучи не в состоянии избавиться от испорченных органов, просто начнет есть всю себя – запустится программа общей аутофагии.
При этом выяснилось, что если отключить уничтожение митохондрий, в клетке не только начнут накапливаться опасные кислородные радикалы, в ней также испортится система синтеза и транспорта белков и липидов, связанная с другим органом – эндоплазматической сетью или эндоплазматическим ретикулумом (ЭР), который представляет собой систему мембранных цистерн и канальцев. Случится так называемый ЭР-стресс, когда в эндоплазматическом ретикулуме начнут накаливаться испорченные белковые молекулы, не способные ни к чему другому кроме как засорению клетки.
Авторы работы показали, что уничтожение митохондрий и разные механизмы программируемой клеточной гибели переплетены друг с другом с одной стороны, и с механизмами развития опухолей, с другой. Особенно ясно это видно на уровне молекул: например белки семейства Bcl-2 регулируют не только апоптоз, но и аутофагию. Белки Bcl-2 подавляют апоптоз, и если их становится слишком много, злокачественные опухоли получают карт-бланш.
Очевидно, противораковые лекарства можно сделать более действенными, если учесть взаимные пересечения различных метаболических путей, определяющих судьбу клеток. То есть, например, для веществ, которые включают в раковых клетках программы суицида, можно повысить эффективность, запретив тем же клеткам уничтожать митохондрии – чтобы они, пожертвовав митохондриями, не избежали собственной гибели.
Автор: Кирилл Стасевич