Разработан высокопроизводительный подход для поиска терапевтических мини-белков против клинически значимых мишеней.
При помощи компьютерного моделирования международный коллектив ученых проверил взаимодействие десятков тысяч небольших белков длиной в среднем 40 аминокислот с гемагглютинином вируса гриппа и ботулотоксином. Путем последовательного отбора молекул с самой высокой эффективностью связывания ученым удалось найти мини-белок, который эффективно защитил мышей от гриппа. Исследование опубликовано в Nature.
Одним из самых эффективных терапевтических подходов в лечении некоторых заболеваний является применение белков, которые связываются с важными мишенями на поверхности вирусов или раковых клеток и инактивируют их. К примеру, для «выключения» поверхностных белков часто используются антитела к этим белкам. Однако антитела имеют сложную структуру, поэтому они зачастую нестабильны и их дорого производить. Более перспективное направление — поиск небольших белковых ингибиторов, которые просты в производстве, термостабильны и при попадании в организм не вызывают иммунного ответа.
Для оптимизации и масштабирования поиска терапевтических мини-белков ученые из университета Вашингтона с коллегами объединили несколько высокопроизводительных методов — компьютерное моделирование, синтез олигонуклеотидов (коротких цепочек ДНК) на чипах, дрожжевой дисплей и секвенирование.
В своей работе ученые поставили задачу подобрать белки, связывающиеся с двумя клинически значимыми мишенями — гемагглютинином вируса гриппа (HA) и ботулотоксином B (BoNT). Гемагглютинин гриппа представлен на поверхности вирусной частицы и необходим для ее прикрепления к клеткам. Его «выключение» при помощи антитела или мини-белка приводит к снижению патогенности вируса. Ботулотоксин — это нервно-паралитический бактериальный токсин, попадание в организм которого приводит к развитию ботулизма. Связывание ботулотоксина препятствует его проникновению в нейроны и развитию токсической реакции.
Чтобы смоделировать связывание мини-белков с мишенями, авторы создали «виртуальные библиотеки» из тысяч аминокислотных последовательностей с несколькими вариантами конформации. Для «обычных» больших белков предсказать укладку полипептидной цепочки невозможно либо очень сложно из-за большого количества возможных вариантов, однако в данном случае ученые работали с последовательностями около 40 аминокислот, для которых хорошо предсказывается вторичная структура. Пользуясь тем, что обе выбранные мишени были ранее закристаллизованы в комплексе с ингибиторами, ученые выбрали ключевые участки мишеней, связывание с которыми инактивировало бы их.
Выбрав при помощи моделирования около десяти тысяч вариантов ингибиторов для HA и BoNT, авторы синтезировали последовательности ДНК, кодирующие эти мини-белки (современные технологии синтеза олигонуклеотидов позволяют синтезировать до десяти тысяч последовательностей длиной около ста нуклеотидов одновременно). Затем полученные «гены» ввели в дрожжевые клетки. В результате клетки на своей поверхности содержали все варианты выбранных мини-белков (в этом суть технологии дрожжевого дисплея).
Клетки инкубировали с разными концентрациями флуоресцентно меченых мишеней, а затем при помощи клеточного сортера отбирали варианты, наиболее эффективно связывающие мишени в самой маленькой концентрации. Со второй попытки ученым удалось создать библиотеку, в которой три процента молекул хорошо связывали HA (342 молекулы).
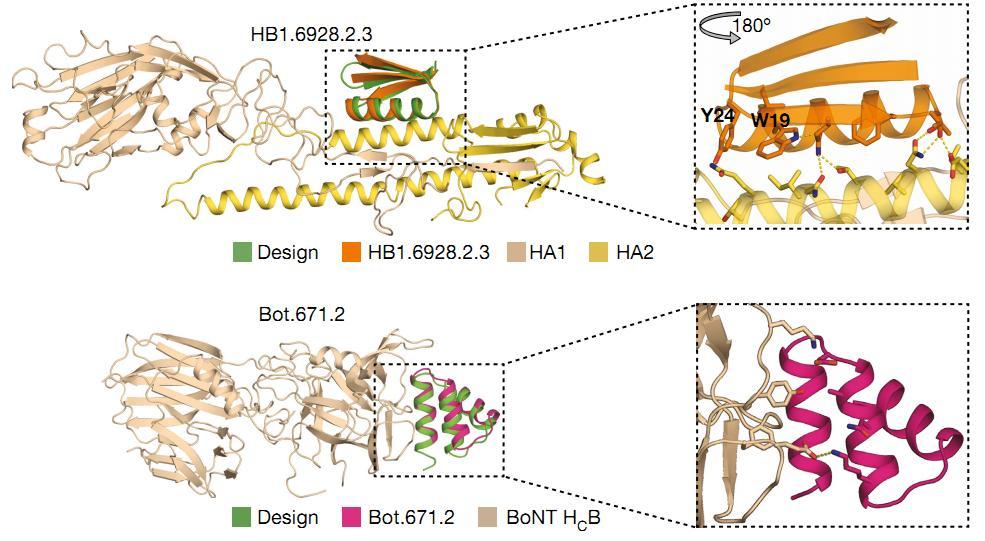
По итогам следующих этапов отбора авторы оставили восемь анти-ботулиновых молекул и шесть анти-гемагглютининовых для испытаний на клетках. Лучшие из них (HB1.6928.2.3 для гемагглютинина и Bot.671.2.1 для ботулотоксина) закристаллизовали вместе с мишенями и показали, что они не только связывают идентифицированные ранее ключевые участки мишени, но и дополнительно взаимодействуют с соседними поверхностями, усиливая эффект. Противогриппозный мини-белок также сравнили с существующим антителом для гемагглютинина и обнаружили, что его эффективная концентрация в сто раз меньше, чем для антитела.
Молекулу HB1.6928.2.3 также проверили на мышах. Интерназальное введение (в нос) ингибитора как до, так и после инфекции летальной дозы вируса привело к тому, что ни одна мышь не погибла. Кроме того, молекула оказалась гиперстабильной и практически не вызывала иммунного ответа в организме животных, поэтому ученые предположили, что она должна хорошо работать в качестве профилактического средства, предотвращая развитие болезни в течение долгого времени после применения.
Об эффективности препаратов на основе связывающих «вредные» мишени белков мы уже писали: к примеру, здесь можно прочитать, как моноклональное антитело излечило подопытных животных от смертельной лихорадки Марбурга, а здесь — как антитела могут помочь против болезни Альцгеймера.
Автор: Дарья Спасская