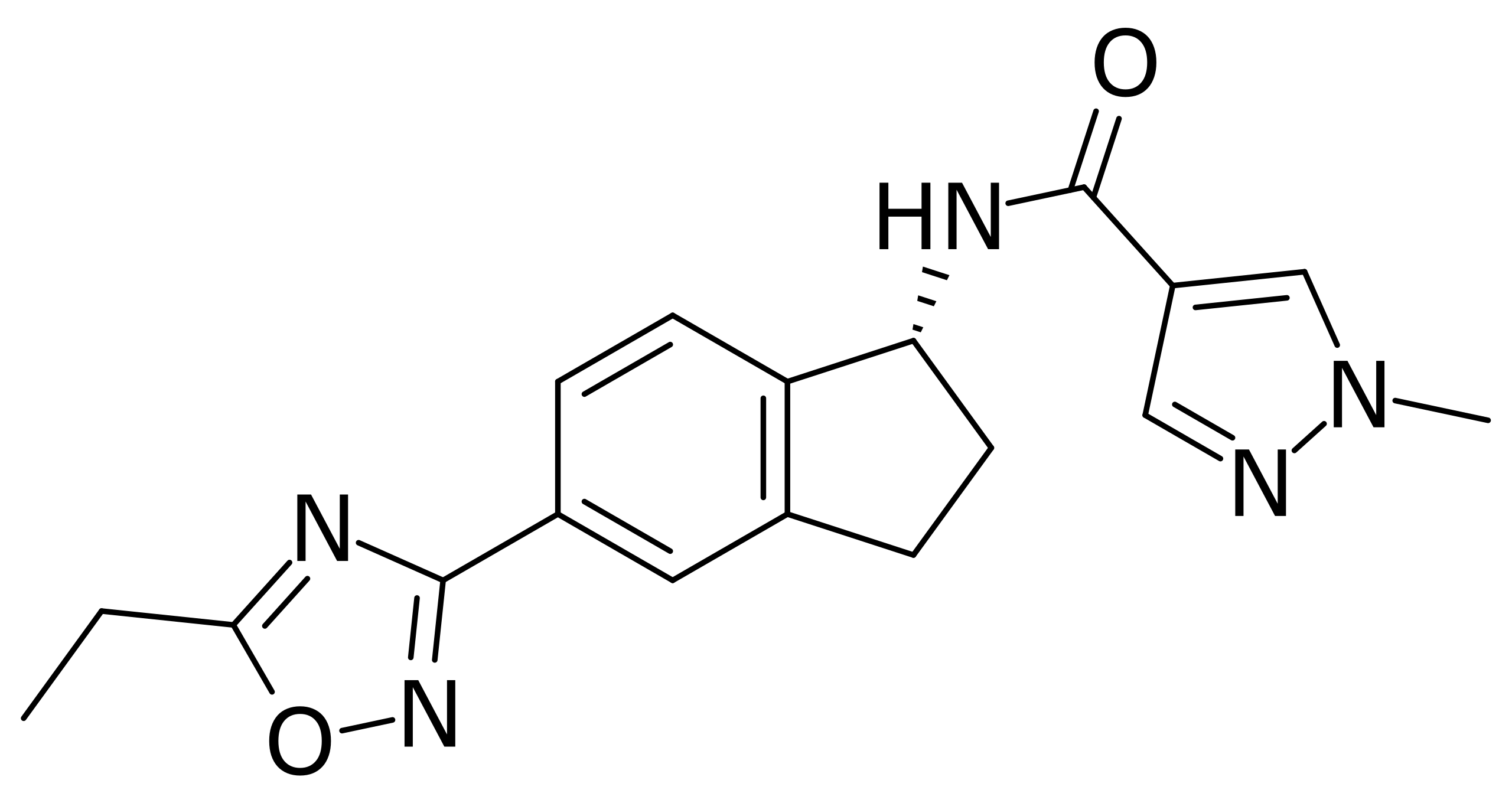
Управление по контролю качества пищевых продуктов и лекарственных средств США (FDA) одобрило афикамтен к применению при симптоматической обструктивной гипертрофической кардиомиопатии — редком наследственном заболевании, которое приводит к прогрессирующей сердечной недостаточности.
Этот препарат связывается с активным центром сократительного белка сердца (миозина), ингибируя его. Это снижает сократимость сердца, уменьшая обструкцию. Афикамтен выпускается в таблетках с дозировками 5, 10, 15 и 20 миллиграмм и предназначен для приема взрослыми пациентами.
Основанием для решения управления стали результаты двойных слепых рандомизированных контролируемых испытаний третьей фазы SEQUOIA-HCM с участием 282 пациентов. Через 24 недели приема активного препарата максимальное потребление кислорода повышалось на 1,8 миллилитра на килограмм массы тела в минуту и не изменялось при назначении плацебо. Также в основной группе у 59 процентов участников уменьшились связанные с заболеванием ограничения физической активности против 24 процентов в контрольной. Европейская комиссия по медицинской продукции также порекомендовала одобрить применение афикамтена в странах Евросоюза.
Автор: Олег Лищук