До 30% пациентов с эпилепсией резистентны к существующим фармакологическим методам лечения. Кроме того, побочные эффекты препаратов включают когнитивные нарушения, депрессию и тревогу.
Одной из потенциальных альтернатив, не имеющих подобных побочных явлений, является оптогенетическая стимуляция, при которой мембранные белки (микробные родопсины) активируются светом определенной длины волны. Ученые Института эволюционной физиологии и биохимии им. Сеченова и МФТИ использовали в качестве оптогенетического инструмента родопсин из морской флавобактерии Krokinobactereikastus (KR2), экспрессировав его в области мозга мышей. Результат работы опубликован в журнале Molecular Neurobiology.
Оптогенетика — довольно новое направление, которое открывает большие перспективы в терапии таких опасных заболеваний, как депрессия, болезнь Паркинсона и эпилепсия. Способность контролировать активность определенных типов клеток может обеспечить более точный способ прерывания эпилептической активности, но пока эти методы только исследуются и совершенствуются.
Так, для нового метода подавления нервной активности группа ученых решила использовать первый известный натриевый насос, управляемый светом, — микробный родопсин из Krokinobactereikastus (KR2). Он представляет особый интерес как потенциальный оптогенетический инструмент нового поколения, поскольку при активации зеленым светом выкачивает ионы натрия, что приводит к снижению активности нейронов. В культуре корковых нейронов мыши активация фототока KR2 приводила к сильному подавлению возбуждения. Еще одним преимуществом Krokinobactereikastus является отсутствие существенного влияния на клеточный кислотно-щелочной баланс, что является документированной проблемой для других светоуправляемых мембранных белков.
«Исследование посвящено применению света для управляемых помп как потенциального инструмента для контроля приступов эпилепсии. Это опасное и пока неизлечимое заболевание, при котором некоторые нервные клетки произвольно активируются, что вызывает болезненные приступы. Причины этого явления точно не ясны: почему перевозбуждаются нервные клетки, по каким причинам остальные клетки готовы воспринять этот сигнал. На текущий момент эпилепсию в целом научились контролировать, есть медикаментозное лечение, но если оно не помогает, применяют хирургическое. Кроме того, встречаются тяжелые случаи, которые лечению не поддаются, а полностью избавить человека от потенциальных приступов пока не представляется возможным. Поэтому все еще актуален поиск новых инструментов лечения», — рассказал об исследовании Федор Цыбров, младший научный сотрудник Центра исследований молекулярных механизмов старения и возрастных заболеваний МФТИ.
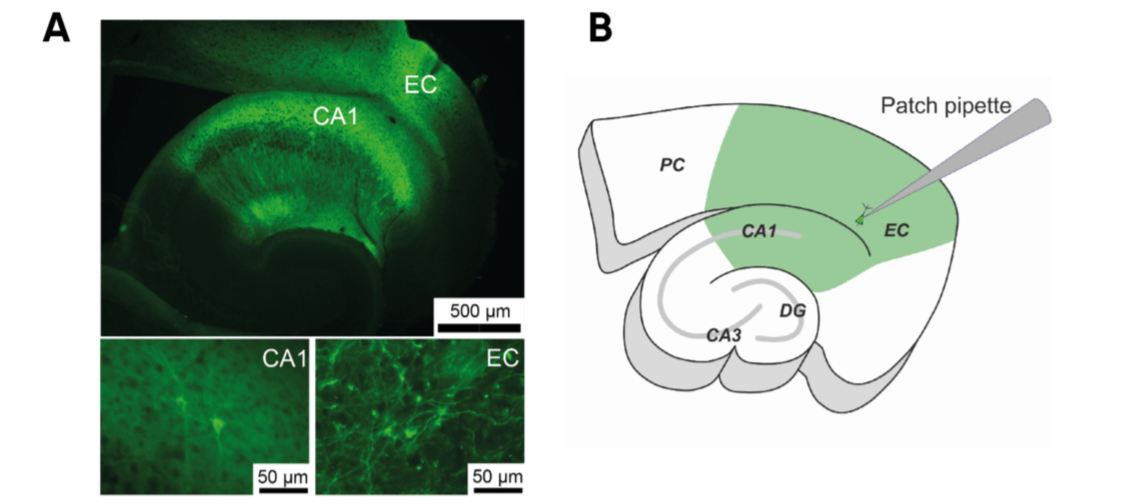
В ходе исследования группа ученых экспрессировала микробный родопсин из флавобактерии Krokinobactereikastus в энторинальной коре и гиппокампе мышей — областях мозга, ответственных за генерацию аномальной активности при височной эпилепсии. Это позволило составить электрофизиологическое описание свойств фототока и его влияния на напряжение мембран нейронов в срезах мозга мышей. Ученые составили протокол фотостимуляции, который эффективно прекращает активность в модели эпилептических припадков.
«Существует несколько оптогенетических методов управления возбудимостью нервных клеток при помощи белков, но у каждого есть свои недостатки и преимущества. В этой работе впервые применили именно натриевые светоуправляемые помпы для подавления приступов и проверили их работу на мышах. Удалось добиться некоторых положительных результатов, которые позволили снизить нервное возбуждение.
Изначально предполагали, что натриевая помпа гиперполяризует клетки. Как известно, нервные клетки поляризованы, у них есть мембранный потенциал, и если мы его увеличиваем, то клетки должны хуже проводить нервные сигналы. В итоге экспериментально доказали, что помпа действительно усиливает потенциал и гиперполяризует клетки, однако полностью подавить этот сигнал не удалось. Возможно, наш белок экспрессируется не во всех клетках, которые активируются при припадке. Существуют другие работы в этой области, доказывающие, что мы можем выключить один центр эпилепсии, но все равно соседние клетки будут продолжать возбуждаться», — дополнил Федор Цыбров.
Также ученые обнаружили довольно интересный косвенный эффект, сложный и многостадийный. Когда с помощью внешних инструментов меняется поляризация мембраны, то в самой нервной клетке есть много других каналов, которые отвечают за активацию или подавление, и на них также можно влиять.
«На наше возбуждение может отреагировать другой потенциалзависимый канал клеточной мембраны, а он, в свою очередь, может приводить к таким эффектам, что импульсы нервных клеток при эпилепсии частично гасятся и пропадают. Таким косвенным образом удалось подобрать параметры для прекращения эпилептических импульсов. В итоге, хоть и не напрямую, а косвенно, мы смогли подавить всплески активности либо значительно снизить», — заключил Федор Цыбров.
Таким образом, использование новой натриевой помпы, управляемой светом, кажется очень многообещающим подходом к подавлению эпилептической активности. Однако на сегодняшний день нет полноценных исследований влияния KR2 на эпилептическую активность или на нейроны областей мозга, участвующих в ее генерации. Поэтому ученые экспрессировали KR2 только в энторинальной коре и гиппокампе мыши, в регионах, ответственных за генерацию.
Текст: Варвара Кравцова