Ученые из Университетского колледжа Лондона (UCL) провели исследование того, как влияют различные генетические транскрипционные факторы на долголетие дрозофилы.
В ходе работы они установили, что такой фактор, как FKH (из семейства Forkhead-box), преимущественно находящийся в нейронах головного мозга, способен различными способами оказывать влияние на борьбу клетки с заболеваниями и ее устойчивость к стрессу. Его чрезмерное количество позволяет увеличить продолжительность жизни насекомого.
Теоретические основы
Жизнь многоклеточного организма – это настоящее волшебство. Мы состоим из самых разных клеток, каждая из которых реагирует на свое окружающее пространство строго определенным образом благодаря действию транскрипционных факторов.
В каждой клетке организма есть весь его генетической код. В зависимости от того, как этот код будет использоваться (то есть в зависимости от экспрессии генов), клетка будет иметь определенный тип, будет выполнять строго заданные задачи. Транскрипционные факторы занимаются регулированием экспрессии генов, то есть управляют процессом производства белков, увеличивая или уменьшая его. Это своеобразные дирижеры жизнедеятельности клетки.
Инсулин – пример гормона белкового типа. Он необходим клетке для роста и метаболизма. Несмотря на его важность в ряде исследований показали, что во взрослом организме дрозофилы его уменьшение может приводить к увеличению продолжительности жизни. Это может говорить о плейотропии инсулина, который играет разные роли на разных стадиях развития организма.
Если так, то влияя на его количество (или на мишени инсулина – рецепторы, например, IGF 1), можно повлиять и на продолжительность жизни клеток. А это, в свою очередь, может открыть секрет долголетия и объяснить причины возникновения нейродегенеративных заболеваний.
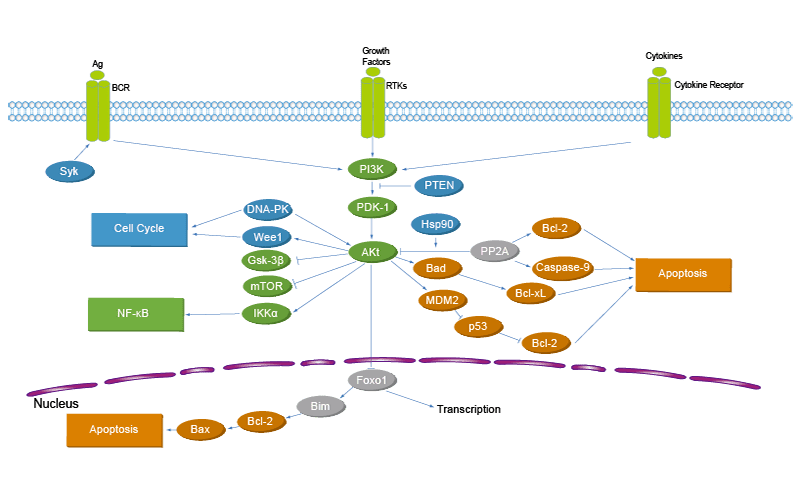
Как же повлиять на количество инсулина? Один из способов – через транскрипционные факторы семейства FOX (Forehead-box), в частности, через белок FOXO и его аналог (ортолог) – белок FKH (которые кодируются, соответственно, генами foxo и fkh). Судя по всему активность инсулина вызывает фосфорилирование белка FKH, при котором фосфор сложным образом прикрепляется к этому элементу. Благодаря этому FKH может взаимодействовать с другими белками (TOR и AKT киназой). Такие взаимодействия образуют сложные сигнальные пути клетки, которые позволяют ей нормально развиваться, связаны с ее пролиферацией, старением и выживанием.
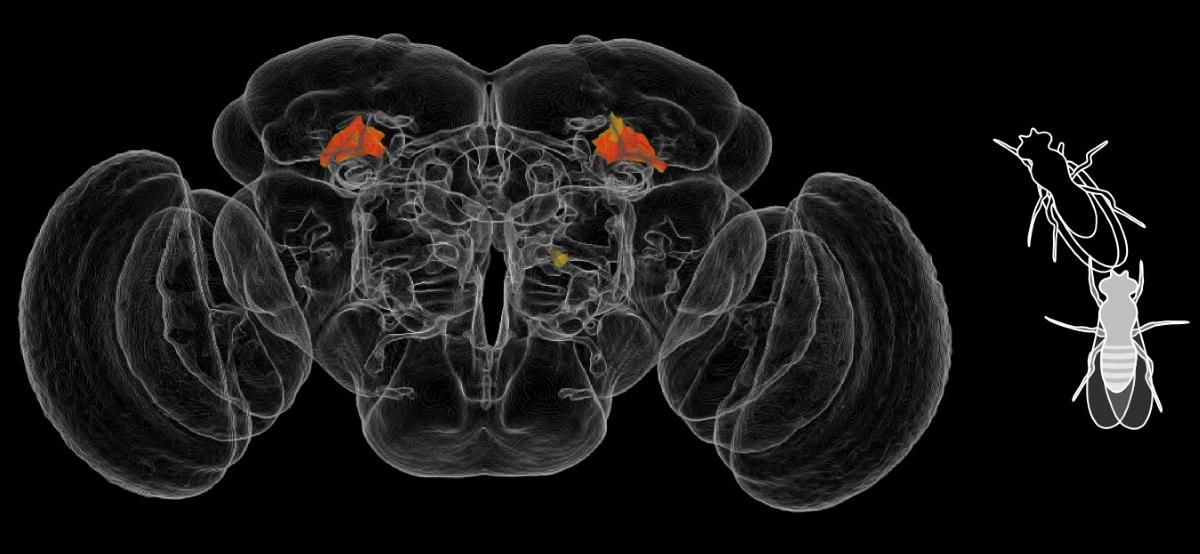
Где находится белок FKH?
Сперва ученые исследовали распространение каждого транскрипционного фактора в нейронах и глии с помощью секвенирования РНК. Ученые смотрели на экспрессию информационной РНК для FOXO и FKH, благодаря которой выяснили, что белки FKH в основном распространены в нейронах, а FOXO – в глиальных клетках.
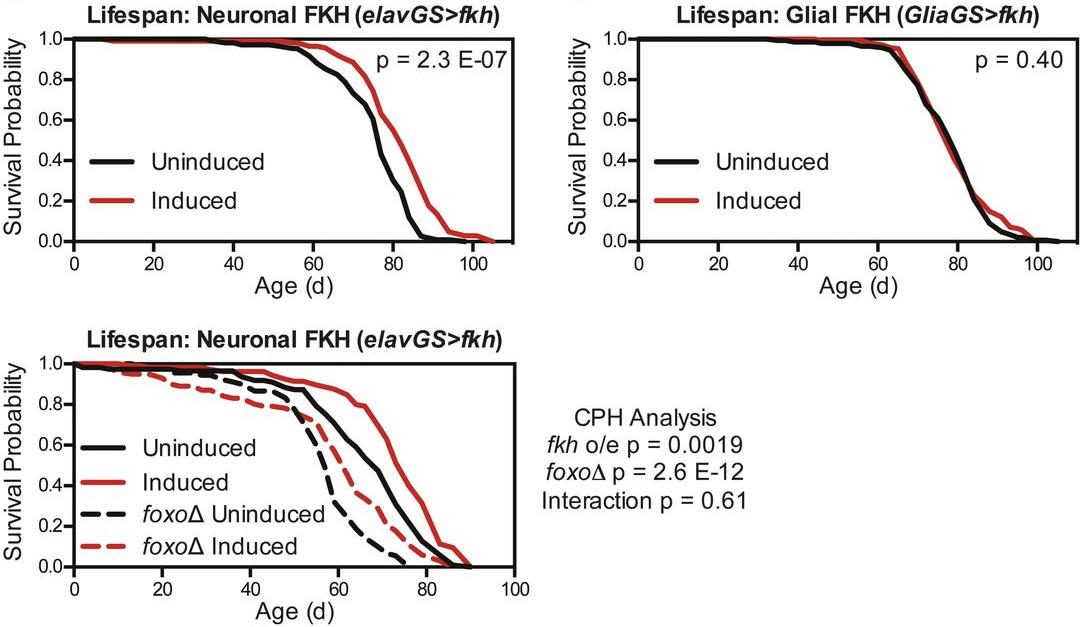
Далее ученые отслеживали начало чрезмерной экспрессии FKH в нейронах взрослых организмов. Рост количества FKH приводил к увеличению продолжительности жизни клетки. При этом влияния белка FKH на плодовитость клетки не наблюдалось.
Действует ли FKH в одиночку?
Ученые решили более тщательно исследовать влияние белка на жизнь клетки. Сперва они задались вопросом о том, как FKH взаимодействует с другими известными факторами, влияющими на продолжительность жизни. В частности, ученые проверили, позволяет ли белок FKH увеличить продолжительность жизни, если все другие факторы остаются в исходном количестве. Быть может, для действия белка FKH нужен также и FOXO, который содержится, в основном, в глии? Оказалось, что чрезмерная экспрессия FKH в нейронах не требует изменений количества FOXO в других клетках.
Тогда, возможно, белку FKH помогают другие элементы? Например, рапамицин – своеобразная панацея от старения. Этот белок воздействует на mTOR киназу (она поэтому и называется Target of Rapamycin), уменьшая ее количество и тем самым увеличивая продолжительность жизни клетки.
Для того, чтобы проверить влияние рапамицина, ученые отключили экспрессию fkh. Это ни к чему не привело: чрезмерная экспрессия рапамицина продлевала жизнь клетки в одинаковой мере – как без, так и с FKH. Отсюда ученые сделали вывод о том, что роль белка FKH более существенна в вопросах долголетия.
Нейродегенерации и ген fkh
В предыдущих исследованиях показано, что длительное уменьшение количества инсулина может оказаться полезным для сохранения функций нейронов при старении и ряде нейродегенераций. В частности, подавление инсулина приводило к замедлению моторного угасания при болезни Альцгеймера. У мышей уменьшение содержания инсулина позволяло дольше сохранять пространственную память особенно тогда, когда нейроны в большом количестве накапливали Aβ – пептид бета-амелоид, запускающий в некотором смысле гибель нейрона.
Ученые предположили, что если уменьшение инсулина позволяло достигать положительного эффекта на течение нейродегенераций, то белок FKH может иметь такие же последствия. Для проверки гипотезы ученые использовали дрозофил с большим количеством пептида Aβ – это насекомое-модель болезни Альцгеймера.
Ученые не обнаружили никакого самостоятельного влияния FKH на моторные способности насекомого. Однако, если предварительно они вводили насекомому препарат мифепристон (RU-486) – средство прерывания нежелательной беременности и антагонист глюкокортикоидов, который способен уменьшить накопление клеткой токсичных белков. Тогда увеличение экспрессии FKH действительно позволяло сохранить моторные функции.
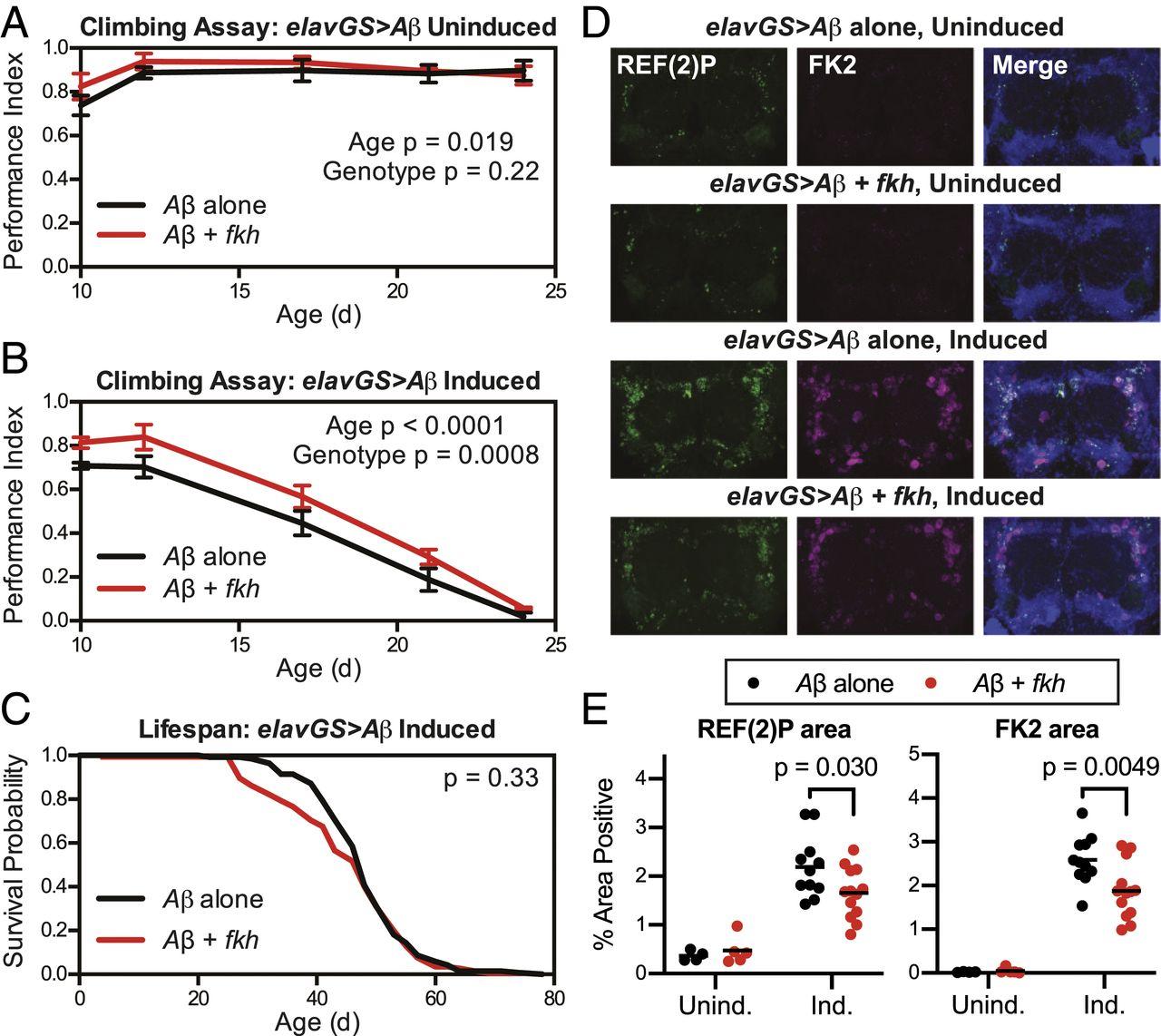
В моделях болезни Альцгеймера на дрозофилах, помимо поведенческих отклонений, проявляющихся в способности насекомого ползать, также можно наблюдать накопление убиквитинированного белка. Это белок, к которому присоединяется убиквитин, участвующий в регулировании процессов деградации элементов клетки.
Чтобы проверить, как FKH повлияет на количество таких белков, ученые измерили накопление убиквитинированного белка в моделях без и с FKH. Присутствие FKH способствовало уменьшению количества такого белка. То есть влияние белка FKH наблюдалось не только на поведенческие особенности при болезни Альцгеймера, но и на клеточную сигнализацию.
Генетические изменения в нейронах
Следующее, что сделали ученые – исследовали транскрипционные генетические изменения в тканях головы дрозофилы (они на 90% состоят из нейронов), возникающие в ответ на уменьшение количества инсулина из-за влияния белка FKH.
Ученые показали, что при уменьшении количества инсулина 84 и 99 генов пересекаются для ситуаций, при которых есть влияние белка FKH или его нет. То есть существенная часть транскрипционного ответа на уменьшение инсулина диктуется именно белком FKH.
На какие гены влияет белок FKH?
Ученые также решили обнаружить гены, которые сильнее всего зависели от экспрессии FKH. Среди up-регуляторов – это гены ImpL2, Thor и foxo. Если отключить функционирование белка FKH, то их экспрессия вскоре вернется на исходный уровень.
Особенное влияние FKH оказывал на ген Atg17. Его экспрессия серьезно возрастала с уменьшением количества инсулина. Этот ген кодирует элементы ATG1-киназы, которая дает клетке команду на начало аутофагии – механизма клетки, при которой она как бы поедает свои отработавшие органеллы, очищая себя изнутри.
Ученые смотрели, в каком количестве экспрессируется Atg17 у насекомых-долгожителей. Анализ ПЦР (количественный) показал значительно большее количество Atg17 у таких насекомых, чем у обычных. Тогда ученые попробовали вызвать у обычных насекомых чрезмерную экспрессию этого гена, что привело к тому, что продолжительность жизни увеличилась.
Таким образом, увеличение экспрессии FOXO в глии и FKH в нейроне может увеличить продолжительность жизни клетки. Более того, белок FKH позволяет сохранять функции нервной системы в моделях болезни Альцгеймера (дрозофилах). Но не будем спешить с выводами, как статья Риа-новости: «Найден главный фактор долголетия мозга». Любое влияние на механизмы старения может повышать риск вызывания злокачественных опухолей. И чрезмерная экспрессия FOXO — не исключение. Вопрос лишь в том, является ли повышение его количества следствием или причиной? Надеемся, будущие исследования ответят на этот вопрос.
Текст: Никита Отставнов