Мигрень это очень распространенное, многофакторное, рецидивирующее наследственное нервно-сосудистое расстройство головной боли. Им страдает более миллиарда человек на Земле.
Приступы мигрени часто начинаются с условной первой фазы – предупреждающих признаков (продромы), затем переходит в условную вторую фазу – ауры (преходящие очаговые неврологические симптомы), происхождение которых, как полагают, связано с гипоталамусом, стволом мозга и корой. Третья фаза – это, собственно говоря, фаза головной боли. Ее пульсирующий характер усиливается с увеличением внутричерепного давления, что проявляется тошнотой, рвотой и ненормальной чувствительностью к свету, шуму и запаху.
Мигрень также может сопровождаться аномальной чувствительностью кожи (аллодиния) и мышечной болезненностью. Таким образом, прослеживая всю симптоматику от фазы до фазы, можно сделать вывод, что при мигренозном приступе целый комплекс нейронных систем головного мозга функционируют ненормально.
Можно с уверенностью сказать, что мозг человека с мигренью отличается от мозга человека без мигрени. Детальному разбору этого тезиса посвящена статья журнала Journal of Neuroscience за 2015 год под авторством Рами Бурштейна и его соавторов. О ней и пойдет речь в нашем пересказе. Мы отдаем себе отчет, что эта статья — в первую очередь, для врачей, но просвещением врачебного сообщества мы тоже хотим заниматься по мере сил. Посему и вводим соответствующий тэг.
Стадии процесса и их патофизиологическая основа
Мигрень — это генетическое заболевание, начинающееся в период полового созревания. Чаще им болеют женщины: соотношение пациенток и пациентов составляет пять к одному. В некоторых случаях головная боль начинается без предупреждающих знаков и заканчивается сном. В других случаях головной боли может предшествовать продромальная фаза, которая включает: усталость, эйфорию, депрессию, раздражительность, тягу к еде, запор, тяжесть в шее, увеличенное зевание и/или ненормальная чувствительность к свету, звуку и запаху.
Фаза ауры включает в себя различные очаговые корковые неврологические симптомы, которые появляются непосредственно перед и/или во время фазы головной боли.
Симптомы ауры мигрени развиваются постепенно, имеют фазы возбуждения и торможения и полностью исчезают. Они могут проявляться в виде мерцающих огней и скотом (слепых участков в поле зрения) при воздействии на зрительную кору; парестезий и онемения лица и рук при воздействии на соматосенсорную кору; тремором и односторонней мышечной слабостью при поражении моторной коры или базальных ганглиев; трудностей с произнесением слов (афазия) при воздействии на область речи.

Соответствующая головная боль, как правило, односторонняя, пульсирующая, усугубляется обычной физической активностью и может длиться от нескольких часов до нескольких дней (Комитет по классификации головной боли Международного общества по головной боли, 2013).
По мере нарастания головной боли она может сопровождаться различными преходящими обратимыми вегетативными симптомами (тошнота, рвота, заложенность носа и пазух, ринорея – обильный насморк, слезотечение, опущение век, зевание, частое мочеиспускание и диарея), аффективными симптомами (депрессия и раздражительность), когнитивными симптомами (дефицит внимания, трудности с поиском слов, преходящая амнезия и снижение способности ориентироваться в привычных условиях) и сенсорные симптомы (фотофобия, фонофобия, мышечная слабость и кожная аллодиния).
Количество этих разнообразных симптомов предполагает, что мигрень – это больше, чем головная боль. В настоящее время она рассматривается как сложное неврологическое расстройство, затрагивающее несколько областей мозга: кору, подкорку и ствол мозга.
Известно, что у мигрени есть триггеры: недостаточный сон, пропуск еды, стрессовые или постстрессовые периоды, гормональные колебания, алкоголь, определенные продукты питания, мерцающие огни, шум или определенные ароматы. Возникает первый вопрос: в каких случаях эти триггеры срабатывают, а в каких нет. Сложно вообразить, чтобы у человека с мигренью приступ начинался после каждого пропуска пищи или после каждого приема алкоголя. Второй вопрос: по каким причинам проходят атаки, они разрешаются сами по себе или просто ослабевают из-за сна, расслабления, приема пищи и темноты.
Также мы должны изучить механизмы, с помощью которых частота эпизодической мигрени увеличивается с течением времени (от ежемесячной к еженедельной и ежедневной), и почему прогрессирование от эпизодической к хронической мигрени является редкостью.
Механизм заболевания
Механистический поиск общего знаменателя в симптоматике и характеристиках мигрени в значительной степени указывает на генетическую предрасположенность к генерализованной нейрональной гипервозбудимости. Увеличение количества доказательств об изменении в структуре и функциях мозга вследствие повторяющихся приступов мигрени, может объяснить прогрессирование заболевания.
Продрома
Продрома – это симптомы, которые предшествуют ауре и головной боли (у некоторых людей мигренозные приступы проявляются продромой и головной болью). Изучение симптомов, которые чаще всего описывают пациенты, указывает на потенциальное вовлечение гипоталамуса (усталость, депрессия, раздражительность, пристрастие к еде и зевание), ствола мозга (болезненность мышц и ригидность затылочных мышц), коры головного мозга (аномальная чувствительность к свету, звуку, и запах), а также лимбической системы (депрессия и ангедония) в продромальной фазе приступа мигрени. Учитывая, что такие симптомы, как усталость, зевание, тяга к еде и преходящие изменения настроения происходят естественным образом у всех людей, очень важно, чтобы мы понимали, как их возникновение вызывает головную боль у пациентов с мигренью и не вызывает ее у здоровых.
В последнее время большое внимание уделяется гипоталамусу, поскольку он играет ключевую роль во многих аспектах циркадных ритмов человека (цикл бодрствования-сна, температура тела, потребление пищи и гормональные колебания) и гомеостаза.
Поскольку мозг человека с мигренью чрезвычайно чувствителен к отклонениям от гомеостаза, раскрытие механизмов, с помощью которых нейроны гипоталамуса и ствола мозга могут вызывать головную боль, является центральным для нашей способности разрабатывать методы лечения, которые могут перехватывать головную боль во время продромальной фазы. Есть предположение, что нейроны гипоталамуса, которые реагируют на изменения физиологического и эмоционального гомеостаза, могут активировать менингеальные ноцицепторы (ноцицептор –нейрон, несущий болевые ощущения), изменяя баланс между парасимпатическим и симпатическим тонусом в мозговых оболочках.
Другое предположение подразумевает, что нейроны гипоталамуса и ствола мозга (регуляторы ответов на отклонения гомеостаза), могут снизить порог для передачи входящих сигналов тригеминоваскулярного нервного пути через таламус в кору. Это предложение основано на понимании того, как таламус отбирает, усиливает и расставляет приоритеты информации, которую он в конечном итоге передает в кору, и как ядра гипоталамуса и ствола мозга регулируют релейные (прямые, без коллатералей) таламокортикальные нейроны.
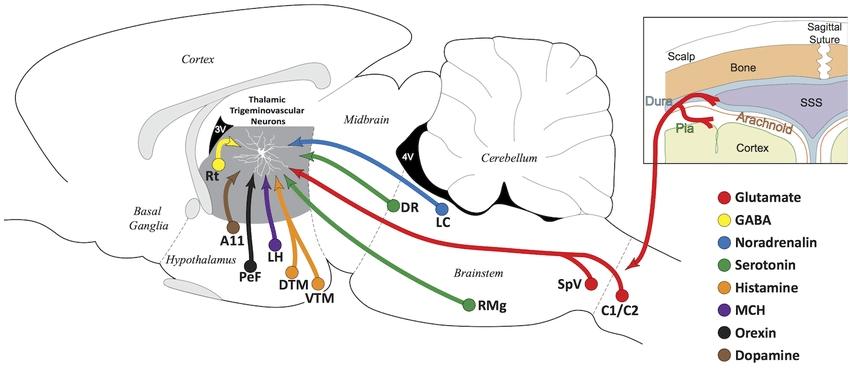
Корковая распространяющаяся депрессия
Клинические и доклинические исследования показывают, что аура мигрени вызвана распространяющейся депрессией коры (CSD) – медленно распространяющейся волной деполяризации/возбуждения, сопровождаемой гиперполяризацией/торможением в корковых нейронах и глиальных клетках.
Хотя конкретные процессы, которые инициируют CSD у людей, не известны, механизмы, которые вызывают воспалительные молекулы в результате эмоционального или физиологического стресса, такого как недостаток сна, могут играть важную роль. В коре начальная деполяризация мембраны связана с большим оттоком калия; притоком натрия и кальция; выделение глутамата, АТФ и ионов водорода, а также запуском каскада провоспалительных реакций. Работа провоспалительных молекул в мозговых оболочках, а также пептида, связанного с геном кальцитонина (CGRP) и оксида азота может быть связующим звеном между аурой и головная болью.
Тригеминоваскулярный путь: от активации к сенсибилизации
Коснемся анатомии мигрени. Тригеминоваскулярный путь передает ноцицептивную информацию от мозговых оболочек к мозгу. Этот путь начинается с периферических нейронов мягкой, твердой мозговой оболочки, крупных мозговых артерий, периорбитальной кожи и перикраниальных мышц. Эти нейроны передают информацию в тройничный ганглий. Центральные аксоны ганлия продолжают путь в ноцицептивные пластины дорсального рога спинного мозга SpV.
Восходящие аксональные проекции тригеминоваскулярных нейронов SpV передают моносинаптические ноцицептивные сигналы следующим ядрам ствола мозга: вентролатеральному, периакведуальному, серому, верхнему слюнному, парабрахиальному, клинообразному, ядру одиночного тракта и ретикулярной формации; ядрам гипоталамуса: переднему, латеральному, перифорническому, дорсомедиальному, супрахиазматическому и супраоптическому; ядрам базальных ганглиев: бледному шару, скорлупе, хвостатому ядру; ядрам таламуса: вентральном постеромедиальном (VPM), заднем (PO), парафаскулярном ядрах.
Эти центры могут иметь решающее значение для возникновения тошноты, рвоты, зевания, слезотечения, мочеиспускания, потери аппетита, усталости, беспокойства, раздражительности, депрессии.
Релейные (без коллатералей) тригеминоваскулярные таламические пути, которые проецируются на соматосенсорную, островковую, моторную, теменную, слуховую, зрительную и обонятельную зону коры, создают специфическую природу головной боли при мигрени и кортикально-опосредованные признаки, ее сопровождающие. К ним относятся преходящие нарушения моторики, трудности с фокусировкой внимания, амнезия, аллодиния, фонофобия, фотофобия и осмофобия.
Активация
Исследования на животных показывают, что корковая распространяющаяся депрессия (CSD) инициирует отсроченную (отсроченное начало головной боли после ауры) или немедленную (немедленное начало головной боли после ауры) активацию периферических и центральных тригеминоваскулярных нейронов. Системное введение открывателя калиевых каналов M-типа KCNQ 2 /3 может предотвратить CSD-индуцированную активацию ноцицепторов. Эти данные подтверждают мнение о том, что начало фазы головной боли мигрени с аурой совпадает с активацией менингеальных ноцицепторов на периферии тригеминоваскулярного пути.
На данный момент неясно, какие сосудистые, клеточные и молекулярные процессы корковой депрессии приводят к активации менингеальных ноцицепторов. Большой объем исследований предполагает, что преходящее сужение и дилатация артерий мягкой мозговой облочки, развитие экстравазации белка плазмы в твердой мозговой оболочке, нейрогенное воспаление, агрегация тромбоцитов и дегрануляция тучных клеток на фоне CSD-зависимого высвобождения CGRP может вводить провоспалительные молекулы в мозговые оболочки, изменяя таким образом молекулярную среду для менингеальных ноцицепторов.
Сенсибилизация
При активации в измененной молекулярной среде, описанной выше, периферические тройнично-сосудистые нейроны становятся сенсибилизированными (порог их ответа уменьшается, а величина их ответа увеличивается) и начинают реагировать на стимулы твердой мозговой оболочки, на которые они показали минимальный или нулевой ответ в начале исследования. Когда центральные тригеминоваскулярные нейроны в пластинках I и V SpV и в ядрах таламического PO/VPM становятся сенсибилизированными, и они начинают реагировать на безобидные механические и термические стимуляции участков кожи головы и вне мозга, как если бы она была вредной. Человеческие корреляты электрофизиологических показателей сенсибилизации нейронов в исследованиях на животных очевидны в контрастном анализе сигналов BOLD, зарегистрированных при сканировании МРТ человеческого тройничного ганглия, спинного тройничного ядра и таламуса во время приступов мигрени.
Клиническое проявление периферической сенсибилизации во время мигрени, для развития которой требуется около 10 минут, включает восприятие пульсирующей головной боли и кратковременное усиление головной боли при наклоне или кашле, действия, которые на мгновение повышают внутричерепное давление. Клиническое проявление сенсибилизации центральных тригеминоваскулярных нейронов в SpV, для развития которой требуется 30–60 мин, а для достижения полной степени — 120 мин, включает развитие признаков головной аллодинии, таких как чувствительность кожи головы и мышц и гиперчувствительность к прикосновению. Эти признаки часто распознаются у пациентов, сообщающих, что они избегают носить очки, серьги, шляпы или любые другие предметы, которые соприкасаются с кожей лица во время мигрени. Клиническое проявление таламической сенсибилизации во время мигрени, которая развивается через 2–4 часа, также включает признаки внечерепной аллодинии, которые заставляют пациентов снимать плотную одежду и украшения и избегать прикосновений, массажа или объятий.
Доказательства того, что триптаны, агонисты 5HT 1B/1D , которые нарушают связь между периферическими и центральными тригеминоваскулярными нейронами в дорсальном роге , более эффективны при прерывании мигрени при раннем применении (то есть до развития центральной сенсибилизации и аллодинии), дополнительно подтверждают идею о том, что менингеальные ноцицепторы управляют начальной фазой головной боли. Дополнительная поддержка этой концепции была недавно предоставлена исследованиями, показывающими, что моноклональные антитела против CGRP, молекулы которых слишком велики, чтобы проникать через гематоэнцефалический барьер (согласно данным производителей), эффективны в профилактике мигрени. Таким образом, точкой приложения для них могут быть только оболочки головного мозга. Кроме того, сообщалось также, что препараты, которые действуют на центральные тригеминоваскулярные нейроны [например, дигидроэрготамин (DHE)], одинаково эффективны на стадии развитой центральной сенсибилизации. Этим можно объяснить эффективность DHE при прерывании мигрени после неудачной терапии триптанами.
Генетика и гипервозбудимый мозг
Генетическая связь с мигренью была впервые обнаружена и определена у пациентов с семейной гемиплегической мигренью (FHM). Три гена, идентифицированные с FHM, кодируют белки, которые регулируют доступность глутамата в синапсе. FHM1 кодирует порообразующую α1-субъединицу кальциевого канала типа P / Q ; FHM2 кодирует α2-субъединицу насоса Na+/K+-АТФазы; и FHM3 кодирует α1-субъединицу нейронного потенциал-управляемого канала Na v 1.1. В совокупности эти гены регулируют высвобождение передатчика, глиальную способность очищать (поглощать) глутамат из синапса и генерацию потенциалов действия. С тех пор , как были получены эти ранние результаты, в крупных исследованиях геномных ассоциаций было выявлено 13 вариантов генов восприимчивости к мигрени с аурой и без нее , три из которых регулируют глутаминергическую нейротрансмиссию , а две из них регулируют синаптическое развитие и пластичность . Эти данные дают наиболее правдоподобное объяснение «генерализованной» нейрональной гипервозбудимости мозга мигрени.
В контексте мигрени повышенная работа в глутаматергических системах может привести к чрезмерной активации рецептора NMDA, что, в свою очередь, может усиливать передачу боли, а также к развитию аллодинии и центральной сенсибилизации. Сетевая, широко распространенная гипервозбудимость нейронов также может быть вызвана таламокортикальной дисритмией, дефектными цепями модуляции ствола мозга, которые регулируют возбудимость на нескольких уровнях вдоль нейраксиса; и изначально неправильная регуляция функций коры, таламуса и ствола головного мозга к лимбическим структурам, таким как гипоталамус, миндалевидное тело, прилежащее и хвостатое ядра, скорлупа и бледный шар.
В этом направлении также заманчиво предположить, что, по крайней мере, некоторые структурные изменения, наблюдаемые в мозге мигрени, могут быть унаследованы и, как таковые, могут быть «причиной» мигрени, а не быть вторичными по отношению к повторным приступам головной боли. Но эта концепция ждет доказательств.
Структурно-функциональные изменения мозга
Изменения мозга можно разделить на следующие два процесса: (1) изменения в работе (функциональности) мозга и (2) изменения структуры мозга. Функционально, различные методы визуализации, используемые для измерения относительной активации в различных областях мозга у мигрени (по сравнению со здоровыми добровольцами), выявили усиление активации в околоводопроводном сером веществе; красном ядре и черной субстанции; гипоталамусе; заднем таламусе; мозжечке, поясной и префронтальной коре, переднем височном полюсе и гиппокампе; и снижение активации в соматосенсорной коре, клиновидном и хвостатом ядре, скорлупе и бледном шаре. Все эти изменения активности произошли в ответ на неповторяющиеся раздражители, а в поясной и префронтальной коре они произошли в ответ на повторяющиеся раздражители.
В совокупности эти исследования подтверждают концепцию, согласно которой мозг мигрени лишен способности привыкать к себе и, следовательно, становится чрезмерно возбудимым. Однако вопрос о том, являются ли такие изменения уникальными для головной боли при мигрени, остается предметом споров.
Существование почти идентичных паттернов активации в других болевых состояниях, таких как боль в пояснице, нейропатическая боль, фибромиалгия, синдром раздраженного кишечника и боль в сердце, повышает вероятность того, что различия между соматической болью и болью при мигрени не связана с различиями в обработке боли в головном мозге.
Анатомически исследования морфометрии и диффузионной визуализации на основе вокселей у пациентов с мигренью (в сравнении с контрольными субъектами) выявили утолщение соматосенсорной коры, увеличение плотности серого вещества в хвостатом ядре и потерю объема серого вещества в верхней височной извилине, средней и нижней лобной извилине, прецентральной извилине, передней поясной извилине, миндалевидном теле, теменной покрышке и островке.
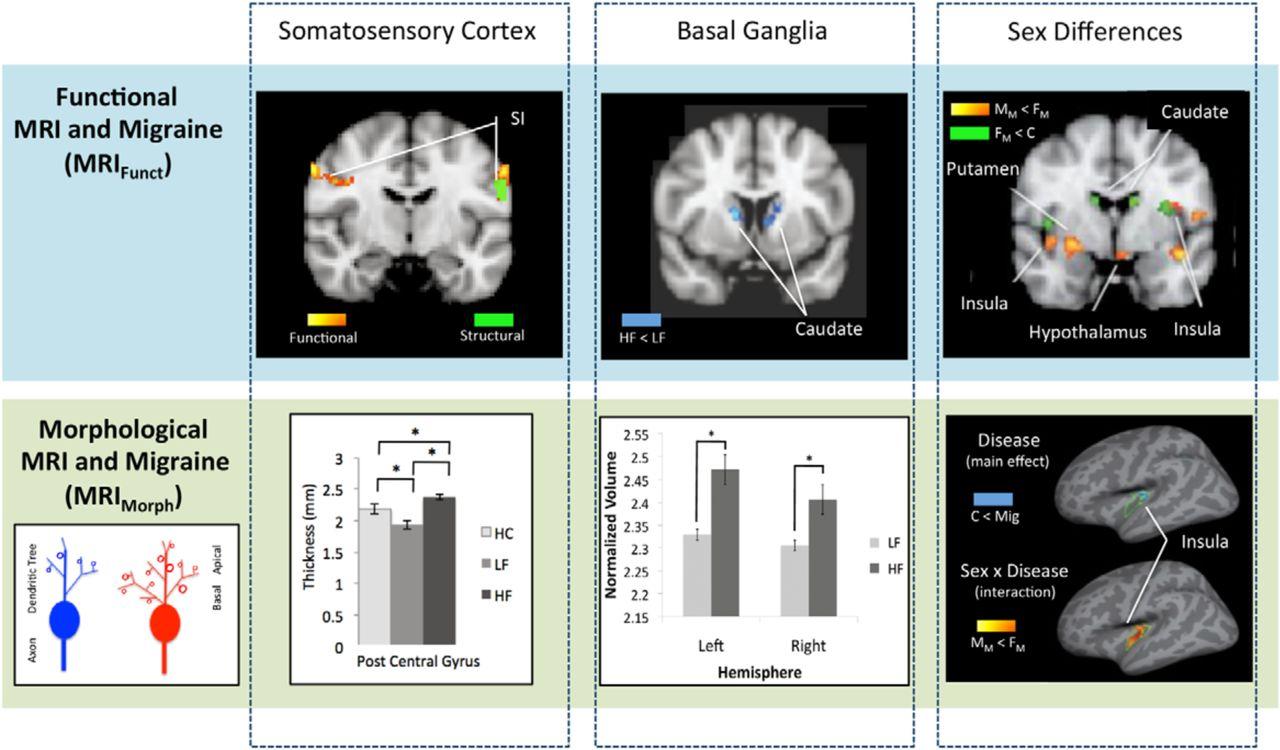
Изменения в корковых и подкорковых структурах могут также зависеть от частоты приступов мигрени для ряда кортикальных и подкорковых областей. Как говорилось выше, неясно, являются ли такие изменения генетически предопределенными или просто результатом повторяющегося воздействия боли. В пользу последних служат исследования, показывающие, что подобные изменения серого вещества, происходящие у пациентов, испытывающих другие хронические болевые состояния, являются обратимыми, и что величина этих изменений может коррелировать с продолжительностью болезнь. Еще более усложняют нашу способность определять, чем мозг мигрени отличается от мозга пациента, испытывающего другие хронические болевые состояния, являются анатомические исследования, показывающие снижение плотности серого вещества в префронтальной коре, таламусе, задней части островка, вторичной соматосенсорной коре, прецентральной и постцентральной извилинах, гиппокампе и височном полюсе у пациентов с хронической болью в спине; в передней и орбитофронтальной коре у пациентов с комплексным регионарным болевым синдромом; в островке, передней части поясной извилины, гиппокампе и нижней височной коре у пациентов с остеоартритом с хронической болью в спине.
Лечение в развитии
Терапия мигрени имеет две цели: положить конец острым приступам и предотвратить следующую атаку. Последнее потенциально может предотвратить прогрессирование заболевания от эпизодического до хронического состояния. Что же касается усилий по прекращению острых приступов, мигрень представляет собой одно из немногих болевых состояний, для которых было разработано конкретное лекарственное средство – триптан — на основе понимания механизмов заболевания. Напротив, усилия по предотвращению возникновения мигрени, вероятно, столкнутся с гораздо более серьезной проблемой, учитывая, что мигрень может возникать в неизвестном количестве областей мозга (см. выше) и связана с генерализованными функциональными и структурными нарушениями головного мозга. Ряд процедур, привлекающих внимание, кратко рассмотрен ниже.
Лекарственные препараты
Самое перпективное лекарство, которое разрабатывается в настоящее время, — это гуманизированные моноклональные антитела к CGRP. Разработка этих моноклональных антител направлена как на сам CGRP, так и на его рецепторы. Концепция основана на локализации CGRP в тройничном ганглии и ее значении для патофизиологии мигрени. В недавних рандомизированных плацебо-контролируемых исследованиях II фазы нейтрализующие гуманизированные моноклональные антитела против CGRP вводили путем инъекции для профилактики рецидива мигрени и показали многообещающие результаты. Примечательно, что одна инъекция может предотвратить или значительно уменьшить приступы мигрени в течение 3 месяцев.
Учитывая наше растущее понимание важности продромы и ауры в патофизиологии мигрени, лекарственные средства, направленные на рецепторы грелина, лептина и орексинов могут рассматриваться как терапевтические разработки, основанные на их способности восстанавливать функцию гипоталамуса. Все это может иметь решающее значение для снижения аллостатической нагрузки и, следовательно, для инициирования следующего приступа мигрени.
Модификация мозга
Нейровизуализационные исследования, показывающие, что нейронные сети, морфология мозга и химический состав головного мозга изменяются как при эпизодических, так и при хронических мигренях, оправдывают попытки разработать методы, которые широко модифицируют сети мозга и их функции.
Транскраниальная магнитная стимуляция, которая, как считается, модифицирует гипервозбудимость коры, становится одним из таких подходов. Другим подходом для генерализованной модификации мозга является когнитивно-поведенческая терапия.
Выводы
Мигрень остается распространенным и плохо излечимым заболеванием. В настоящее время не существует объективного диагноза или лечения, которое было бы универсально эффективным для прерывания или предотвращения приступов. Мигрень представляет собой неврологическое состояние, при котором системы, которые постоянно оценивают ошибки часто терпят неудачу, таким образом увеличивая аллостатическую нагрузку (избыточную реакцию организма на стрессовое состояние).
Учитывая огромные материальные потери для общества от мигрени, необходимо срочно сосредоточиться на лучшем понимании нейробиологии заболевания, чтобы дать возможность открыть новые подходы к лечению.
Текст: Марина Калинкина
