Количество методов для изучения глубоких нейронных сетей головного мозга и связанного с их активностью поведения довольно ограничено. До недавнего времени одним из самых популярных методов с гигантским потенциалом была оптогенетика. Однако теперь, по-видимому, на ее место встанет магнитогенетика.
Исследователи из Южной Кореи разработали новую стратегию целенаправленной магнитогенетической стимуляции глубоких нейронов головного мозга мышей и протестировали ее эффективность в контексте изменения поведения животных. Результаты исследования, опубликованные в в журнале Nature Nanotechnology, крайне интересны. Разберемся, в чем же состоит суть технологии и каков ее потенциал не только в изучении функций определенных нейронных цепей головного мозга, но и в регуляции поведения.
Методы так называемого целевого изменения активности нейронов (то есть активации только определенной группы нейронов головного мозга), такие как оптогенетика, все сильнее набирают обороты популярности в контексте изучения связей между нейронами и функций мозга. Однако важный недостаток оптогенетики состоит в том, что ее реализация требует импланитирования в череп мышей источников света для активации нейронов. Это мешает свободным движениям животных, которое важно сохранять на естественном уровне для изучения некоторых функций мозга. В качестве альтернативы предлагается еще один способ – магнитогенетика.
Магнитогенетическая нейромодуляция предлагает беспроводную и дистанционную глубокую стимуляцию мозга, что покрывает недостатки как высокоточной оптогенетики, так и менее точной, но применяющейся и на людях электрической стимуляции. Однако из-за ограниченного понимания принципов работы и плохо спроектированных магнитных операционных систем более ранние магнитные подходы еще не использовались.
В новом исследовании ученые из Южной Кореи представили новую стратегию магнитогенетической стимуляции глубоких нейронных сетей головного мозга с учетом типа клеток у живых свободно двигающихся животных. Эта технология устраняет необходимость в каких-либо имплантатах и позволяет проводить нейронную стимуляцию на больших расстояниях и в больших объемах с широким потенциалом применения в нейробиологических исследованиях у животных, которые свободно движутся, в практически любом экспериментальном контексте.
О методе
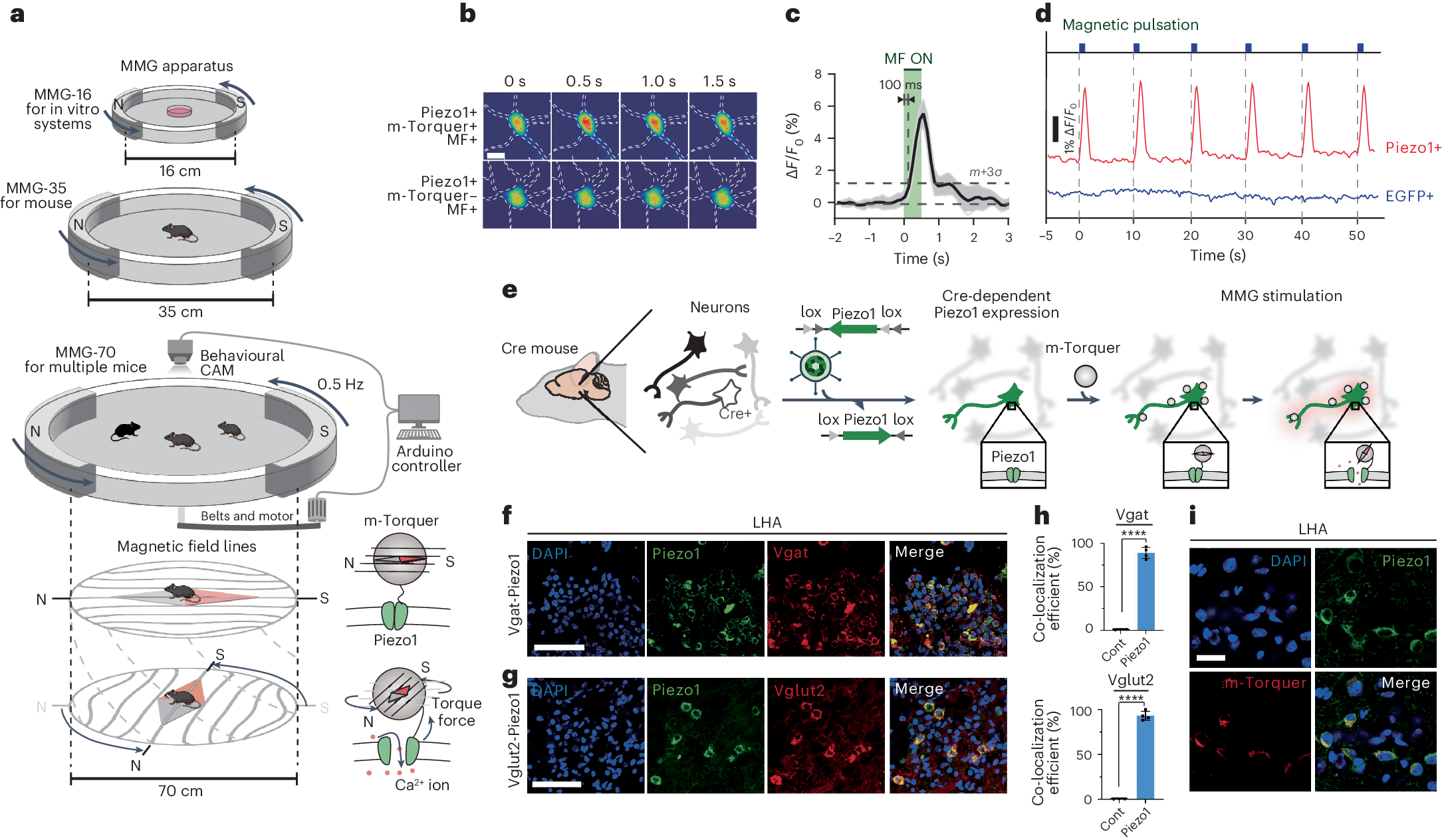
Установка для магнитогенетической стимуляции (МГС), в который помещались экспериментальные животные, представлял собой металл-оксидную камеру для мониторинга поведения и генератор вращательной магнитной силы. Этот генератор (m-Torquer) – комплекс магнитных наночастиц, вводимых в мозг мышей и генерирующих крутящую силу под действием вращающегося магнитного поля. Он необходим для того, чтобы активировать механочувствительные ионные каналы Piezo1 для входа кальция и последующего нервного возбуждения.
В исследование включили две группы мышей, которым с помощью вируса вводили механочувствительные ионные каналы, встраивающиеся или в ГАМКергические нейроны, или в глутаматергические. Доставлялись они в две области: латеральный гипоталамус и медиальную преоптическую область. Латеральный гипоталамус содержит ГАМКергические и глутаматергические нейроны с взаимодополняющими функциями, которые вместе образуют нейронные цепи, регулирующие сложное поведение, включая питание и вознаграждение.
После введения всех компонентов исследователи запустили МГС и подтвердили возникшую вследствие этого нейронную активность, которая увеличилась по сравнению с контрольной группой более чем на 20%. Затем приступили к поведенческим тестам.
Как МГС изменила поведение животных
Исследователи решили изучить несколько типов сложного поведения мышей: пищевое, социальное и материнское.
В первом случае МГС вызвала острое пищевое поведение у мышей со сверхактивированными ГАМКергическими нейронами. В сравнении с контрольной группой продолжительность приема пищи у таких мышей увеличилась более чем в 2 раза. И, напротив, у мышей со сверхактивированными глутаматергическими нейронами пищевое поведение прекращалось, и мышь удалялась от зоны питания. Общее время приема пищи у таких животных сократилось также в два раза. Поведенческая модуляция посредством стимуляции МГС может длиться до ~ 7 недель, пока сохраняется экспрессия механорецепторов в гипоталамусе.
Еще систему протестировали на мышах с ожирением. Мышей, которые 11 недель содержались на специальной «жирной» диете, ежедневно в течение двух недель стимулировали по одному часу. У мышей со сверхактивированными глутаматергическими нейронами (с механорецепторами) МГС привела к значительной потере веса и уменьшению ожирения, тогда как в контрольной группе этого не произошло. При этом снижение веса регистрировалось ежедневно. В случае с ГАМКергическими нейронами, экспрессирующими Piezo1, напротив, после двух недель стимуляции наблюдались значительный прирост веса, увеличение потребления пищи и усугубление ожирения.
В случае социального поведения мышам в специальные клетки для МГС подсаживали других мышей и оценивали их реакцию на соседство с новой мышью или на пустую клетку. При МГС ГАМКергических нейронов гипоталамуса мыши проводили в два раза больше времени с новыми соседями, чем с пустой клеткой по сравнению с контрольной группой. Кроме того, мышам также подсаживали уже знакомых им коллег-грызунов. В таком случае с новыми соседями мыши проводили гораздо времени, чем со знакомыми.
И наконец, что касается материнского поведения. Здесь целенаправленной активации подверглись уже нейроны медиальной преоптической области – ключевой области регуляции эмоциональных состояний и материнского поведения. В экспериментальную клетку с натуралистическими ландшафтами помещали мышь со сверхактивированными ГАМК-нейронами, мышь из контрольной группы и четырех детенышей. Одного из детенышей поместили в зону гнезда, а трех других детенышей разместили в дальних местах от гнезда. При МГС мышей с измененными ГАМК-нейронами они быстрее приближались к детенышам и быстрее возвращали всех трех детенышей в гнездо во всех испытаниях. Также у них проявлялась значительно увеличенная продолжительность типичного родительского поведения самок по сравнению со всеми контрольными группами.
К статье исследователи также приложили видеозаписи, на которых демонстрируются все эксперименты и поведение мышей в установке.
Таким образом, исследователи разработали весьма эффективный способ изучения функций локализованных нейронов, который при этом не требует никаких инвазивных структур, мешающих свободному передвижению животных. И хотя этим же преимуществом обладает и хемогенетика, она, однако, ограничена относительно грубым временным разрешением. МГС же обеспечивает более точный временной контроль нейронной активности и поведения с задержкой на уровне секунд.
Нынешняя версия МГС использует только один тип механочувствительных ионных каналов – Piezo1, – но разработка МГС с другими ионными каналами расширит его возможности. Авторы исследования уверяют, что их труд может способствовать продвижению за пределы нейробиологии в широких областях наук о жизни и медицины.
Текст: Анна Удоратина