В отчете ученых из Университета Джонса Хопкинса, опубликованном в Nature, приводится исследование структуры дельта-типа ионотропного глутаматного рецептора (iGluR или GluD), функция которого в клетках мозга оставалась дискуссионной.
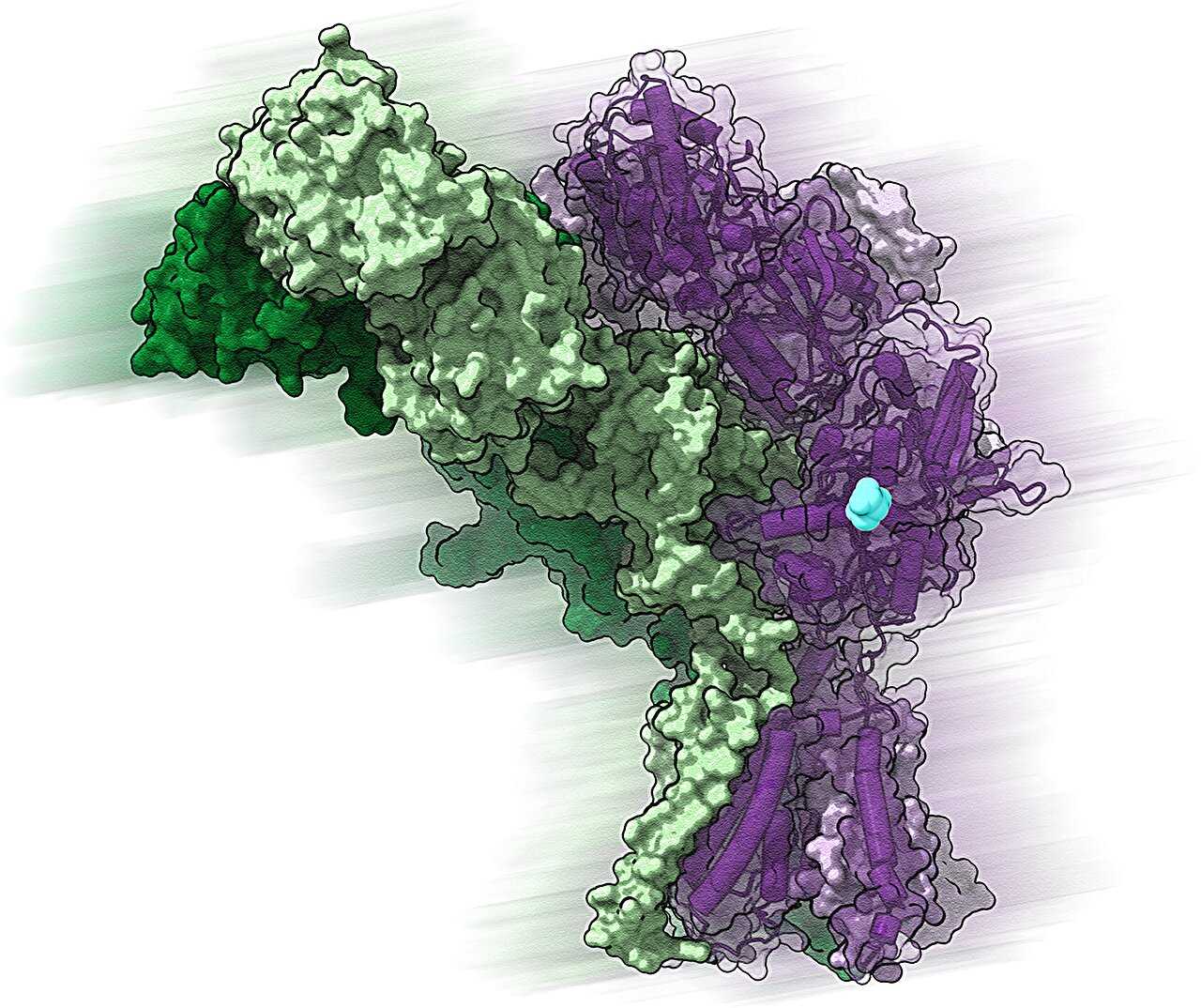
Поскольку изучение проводилось при помощи криоэлектронной микроскопии, удалось увидеть структуру рецептора в «рабочем» положении. Это может помочь найти препараты против некоторых заболеваний мозга. Работа показалась редакторам Nature настолько важной, что они опубликовали «unedited version» статьи для раннего доступа к открытию. Так что правки еще могут быть.
Давно известно, что белки, называемые дельта-подобными ионотропными глутаматными рецепторами, или GluD, играют важную роль в передаче сигналов между нейронами. Предполагалось, что мутации в белках GluD приводят к психическим расстройствам, в том числе к повышенной тревожности и шизофрении. Однако учёные мало что знали о том, как функционируют GluD, что затрудняло поиск способов их регулирования.
«Долгое время считалось, что этот класс белков находится в неактивном состоянии в мозге, — говорит последний автор статьи Эдвард Туми (Edward C. Twomey), доцент кафедры биофизики и биофизической химии (три науки вместе соединили!) в Медицинской школе Университета Джонса Хопкинса. — Наши результаты показывают, что они очень активны и могут стать потенциальным направлением для разработки новых методов лечения».
Используя метод криоэлектронной микроскопии, позволяющий увидеть «моментальную фотографию» белка в его физиологическом состоянии (метод был удостоен Нобелевской премии по химии в 2017 году), авторы смогли разглядеть структуру и механизм работы GluD.
Оказалось, этот вариант глутаматного рецептора активируется D-серином и γ-аминомасляной кислотой (ГАМК) с усиленной активацией при физиологических температурах (напомним, что в организме белки состоят из L-аминокислот, но D-серин тоже присутствует, он получается из L-серина при помощи фермента серин-рацемазы и выполняет функцию, например, эндогенного лиганда NDMA-рецептора).
Сам GluD оказался сложно организованным ионным каналом, состоящим из четырех субъединиц. Собственно сам ионный канал непосредственно соединен с «двустворчатыми» лиганд-связывающими доменами, которые координируются аминоконцевым доменом над ионным каналом.
Новое открытие может помочь ускорить разработку лекарств и создание методов лечения таких заболеваний, как мозжечковая атаксия — нарушение координации движений и равновесия, которое может быть вызвано инсультом, черепно-мозговой травмы, опухолями головного мозга и некоторыми нейродегенеративными заболеваниями. При этом заболевании, которое также может вызывать проблемы с памятью, глутаматные рецепторы становятся «сверхактивными» даже при отсутствии нервных импульсов. По словам Туми, для потенциального лечения мозжечковой атаксии учёные могли бы найти молекулу, блокирующую гиперактивное состояние глутаматных рецепторов.
Наоборот, при шизофрении, когда глутаматные рецепторы менее активны, лекарства потенциально могут повышать их активность.
Текст: Алексей Паевский