Исследователи из Австрии и Бельгии определили, почему недоношенные дети чаще страдают когнитивным дефицитом, и предложили возможный вариант исправления этой ситуации.
В журнале Cell Host & Microbe они сообщают о том, что крайне необходимо обращать внимание на развитие нормальных взаимосвязей в линии «кишечник-микробиота-иммунитет-мозг», иначе заселение неподготовленного к жизни вовне матки кишечника патологическими микроорганизмами нарушит формирование связей в мозге.
Частота преждевременных родов растет во всем мире и становится одной из ведущих причин перинатальной заболеваемости и смертности. Хотя последние достижения в области интенсивной терапии новорожденных увеличили выживаемость крайне недоношенных младенцев (гестационный возраст <28 недель), процент выживших с тяжелыми заболеваниями и пожизненными нарушениями нейродинамического развития остается высоким.
Третий триместр беременности — это критический период для установления, совершенствования и созревания связей человеческого мозга, которые определяют последующий когнитивный потенциал. Крайне недоношенные дети рождаются на пороге третьего триместра, и поэтому их нейронные сети формируются в условиях множества факторов, связанных с преждевременной внематочной жизнью.
Один из таких факторов – немедленная послеродовая колонизация организма микроорганизмами. Формирующаяся микробиота кишечника находится в тесном контакте со множеством нейронов кишечной нервной системы. Микробиота – это важный стимулятор иммунологической толерантности, поскольку природа и количество микробных антигенов определяют реакцию лимфоцитов.
Недоношенные дети подвергаются значительному риску перенесения перинатальных повреждений белого вещества. Хотя микробиота кишечника участвует в развитии в раннем возрасте, связь «кишечник-микробиота-иммунитет-мозг» у недоношенных новорожденных отсутствует.
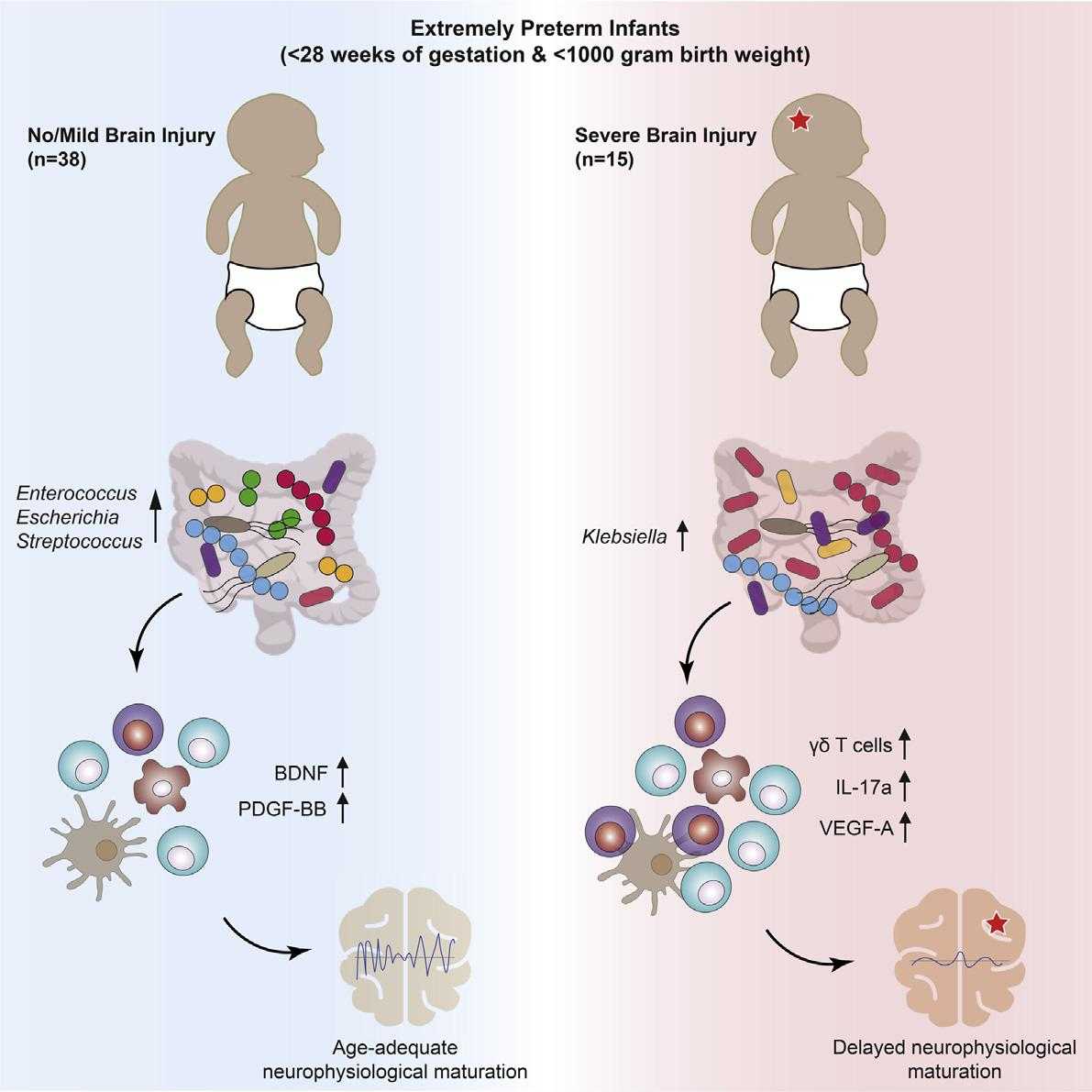
В своем исследовании ученые проанализировали микробиоту кишечника, иммунологическое и нейрофизиологическое развитие 60 крайне недоношенных детей (гестационный возраст менее 28 недель, вес менее 1 килограмма), которые получали стационарную помощь, включая антибиотики и пробиотики. Из 60 младенцев 7 умерли, у 38 головной мозг был в норме или же имел незначительные изменения, а у 15 младенцев были диагностированы тяжелые патологические изменения головного мозга.
В ходе исследования ученые отслеживали нейрофизиологическое развитие, отбирали образцы кала и брали кровь с определенным временным интервалом. Повреждения головного мозга выявлялись с помощью комбинированной оценки результатов ультразвукового исследования в различные моменты времени во время госпитализации, а также с помощью магнитно-резонансной томографии (МРТ).
Для характеристики нейрофизиологического развития у пациентов ученые использовали суммарную оценку амплитудно-интегрированной электроэнцефалографии (аЭЭГ).
Используя методы системной биологии, ученые в случае детей с нарушениями мозга выявили чрезмерный рост бактерий Klebsiella в кишечнике. Кластерный анализ микробиома показал, что доминирующие сообщества Klebsiella кишечника были удивительно стабильными и наблюдались исключительно у младенцев с патологиями.
Также авторы зарегистрировали повышение уровня Т-лимфоцитов в периферической крови недоношенных детей с серьезными нарушениями мозга.
Таким образом, ученые пришли к выводу, что отклонение развития взаимосвязанной линии «кишечник-микробиота-иммунитет-мозг» может играть роль в нарушении формирования мозга у крайне недоношенных новорожденных. Иммунологические изменения в сочетании с последующим истощением нейропротекторных средств могут повлиять на нейрофизиологическое развитие и созревание нервной системы.
Эти результаты свидетельствуют о том, что новые терапевтические меры с возможным добавлением пробиотиков, направленные на улучшение связи «кишечник-микробиота-иммунитет-мозг» могут иметь потенциал для повышения выживаемости недоношенных новорожденных.
Текст: Денис Бурляй