Порядок, в котором разные части ДНК удваиваются перед делением, оказался важен для поддержания их эпигенетического состояния — говорится в исследовании, опубликованном в журнале Science.
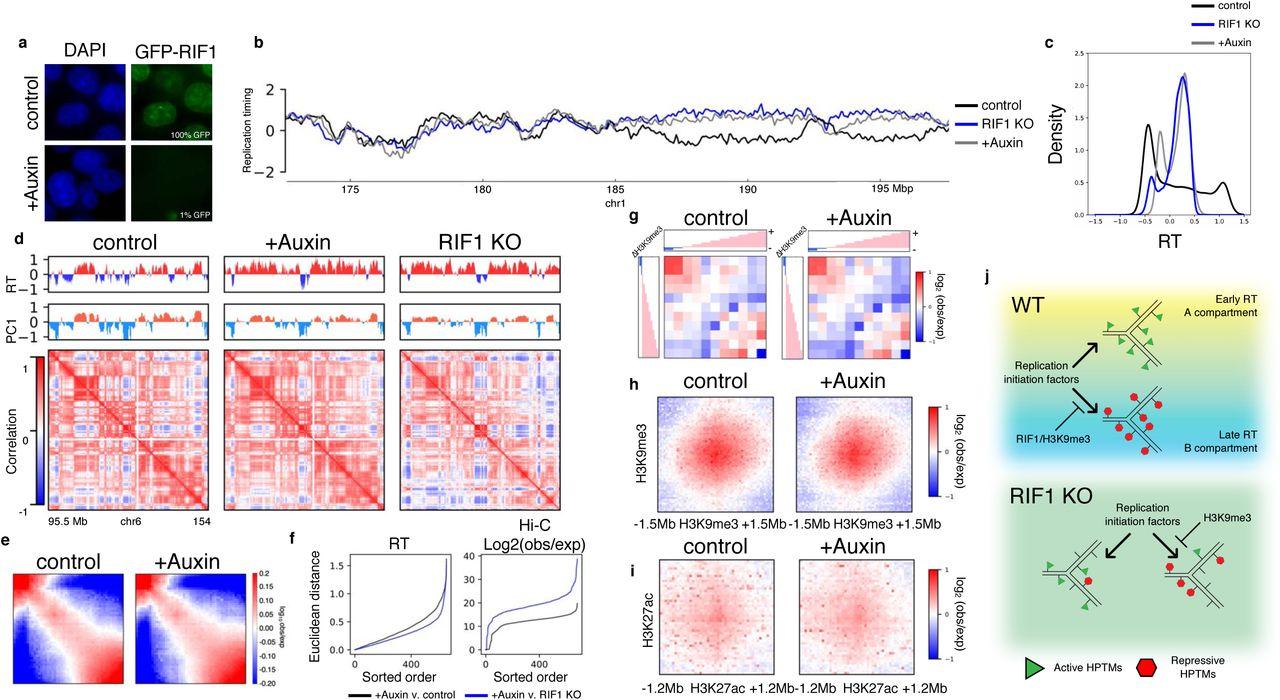
Биологи придумали способ сбить тайминг репликации и заставить сегменты ДНК удваиваться в случайном порядке при помощи нарушения работы гена RIF1. Из-за сбитого тайминга репликации нарушились эпигенетические параметры: метилирование белков-упаковщиков ДНК и трехмерная структура генома.
Самым важным открытием в биологии последнего столетия стало выяснение роли ДНК в формировании признаков организмов и расшифровка генетического кода. Однако в последнее время исследователи все больше внимания обращают не только на нуклеотидную последовательность генома, но и на эпигенетические факторы — они не затрагивают последовательность нуклеотидов, но наравне с ней влияют на активность генов и наследуются. К таким факторам относится метильные и ацетильные метки, которые навешиваются на нуклеотиды и белки-упаковщики ДНК. Это мечение влияет на работу ферментативной машины транскрипции: например, считается, что ее сродство к метилированным генам снижается и те хуже работают.
Один из самых интересных вопросов эпигенетики — сохранение меток ДНК и белков при размножении клеток. Если скопировать последовательность ДНК в дочернюю клетку относительно просто — в процессе репликации весь геном удваивается и делится между двумя новыми клетками — то с эпигеномом все не так просто. Известно, что на новосинтезироанную ДНК метки навешиваются заново после репликации, но точный механизм этого процесса пока не понятен.
Исследователи из университета Флориды под руководством Кайла Кляйна (Kyle N. Klein) изучили связь возникновения эпигенома и тайминга репликации — «расписания», по которому удваиваются разные сегменты ДНК перед делением. Они удалили из разных клеточных типов белок RIF1, который участвует в репликации, и показали, что это полностью сбивает тайминг: участки ДНК начинают синтезироваться в случайном порядке. Такие клетки биологи использовали, чтобы изучить, как тайминг влияет на другие процессы в клетке.
Ученые проверили, как тайминг связан с метильными метками на белках-упаковщиках ДНК. В норме они нужны в том числе для разметки и выключения ненужных генов. Оказалось, что без тайминга репликации метилирование изменилось во всех районах генома.
Считается, что позже всего перед делением удваиваются плотно упакованные районы — такие клубки из нитей ДНК, в которых гены не работают. Организацию и разделение генома на открытые и упакованные части изучают при помощи Hi-C карт, на которых показывают частоту взаимодействия между районами генома — то есть его трехмерную структуру. Например, там, где ДНК упакована плотно, контактов между участками будет больше.
Такие карты ученые построили и для клеток, в которых нарушен тайминг репликации. Оказалось, что трехмерная структура генома этих клеток отличается от нормальной. Интересно, что она коррелировала с измененным метилированием гистонов: плотно упакованные районы разделились на два типа — метилированные и неметилированные.
Так ученым удалось показать, что тайминг репликации необходим как для правильного распределения эпигенетических меток, так и для трехмерной организации генома. Согласно их результатам, первичным для клетки все же является тайминг, а не трехмерная структура. Теперь биологам предстоит выяснить, механизмы влияния тайминга на эпигеном.
Эпигенетические изменения — сейчас одна из самых исследуемых областей. Прежде всего, эпигенетику изучают в связи с механизмами старения. Недавно эпигенетическое старение даже удалось обратить вспять при помощи коктейля из гормонов и антидиабетических средств. А о трудностях, которые испытывает современная наука в попытках найти определение старению, читайте в материале «Дело не в морщинах».
Автор: Анна Муравьева