Биологи создали биосенсоры, которые заставили бактерии поменять свои предпочтения и расти только в заданных учеными тканях и органах.
Таким образом авторы опубликованной в Nature Biomedical Engineering работы надеются ускорить создание новых инструментов для терапии онкологических заболеваний: бактерии смогут уничтожать опухоли, не поражая при этом здоровые ткани.
Среди множества задач в синтетической биологии, с медицинской точки зрения ученым интересно заставить бактерии расти только в определенных условиях окружающей среды – например, в определенных тканях или опухолях организма-хозяина. Теоретически, это возможно при помощи генетического программирования бактерий. В будущем такой подход может изменить существующие методы диагностики и лечения воспалений, инфекционных и онкологических процессов. При этом очень важно, чтобы лечебные бактерии могли расти только в пораженных тканях, чтобы не повредить здоровые органы и не вызвать септический шок. Соответственно, нужно разработать такие генетические конструкции, которые будут заставлять бактерии делиться только в заданных биологами и медиками условиях.
Большинство уже существующих стратегий по сдерживанию бактерий опираются на природные предпочтения микроорганизмов к некоторым средам (кожа, желудочно-кишечный тракт). Однако множество бактерий могут расти и вне своих привычных ниш, быстро распространяясь в неожиданных местах и вызывая нежелательные эффекты.
Ученые из Университета Колумбия под руководством Таль Данино (Tal Danino) предложили настраивать предпочтения бактерий, используя инженерные генетические конструкции. При помощи таких генетических схем можно запрограммировать клетку чувствовать один или несколько отличительных физиологических признаков, и расти в зависимости от их наличия.
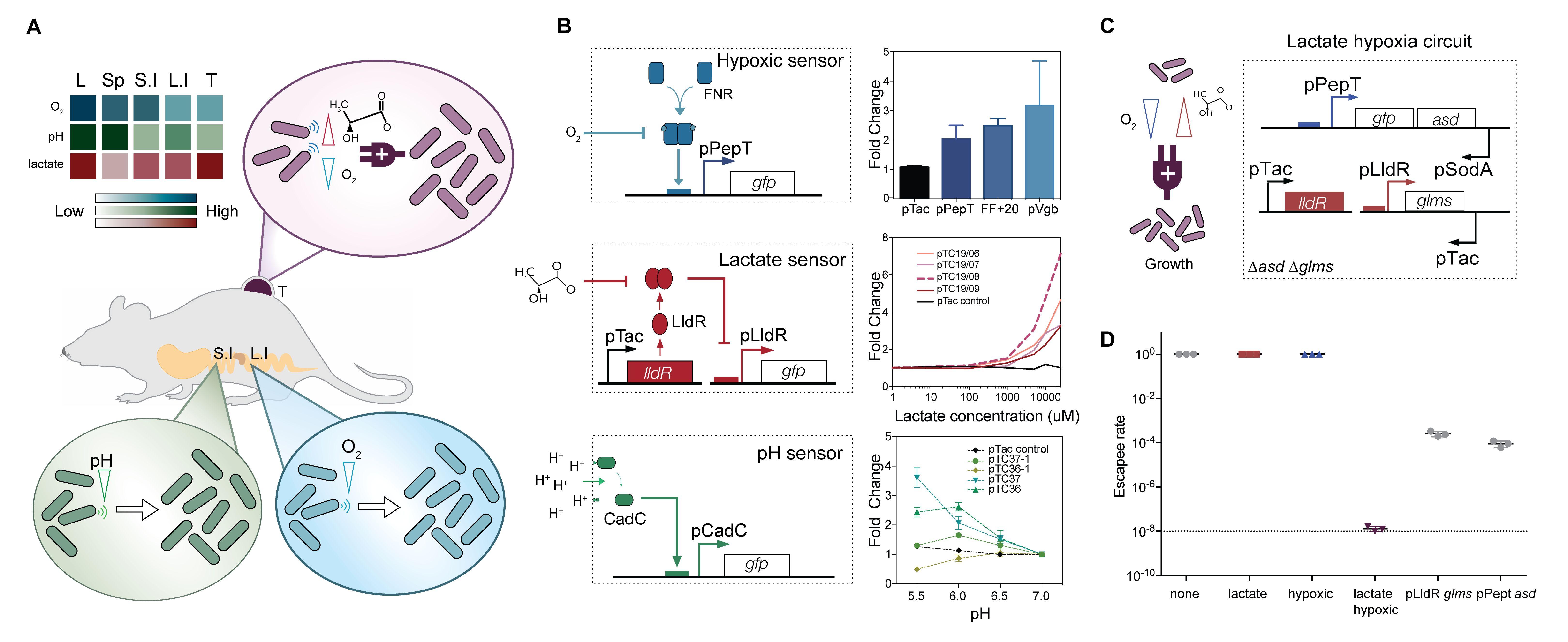
Чтобы создать подобные бактериальные биосенсоры, биологи выбрали кислород, водородный показатель (pH) и соли молочной кислоты в качестве распространенных отличительных признаков различных сред организма. Чтобы клетки распознавали присутствие кислорода, команда использовала чувствительный к гипоксии промотер, который управляется белком-активатором транскрипции. Этот белок запускает считывание генов, которые находятся вслед за промотером, только если в клетке отсутствует кислород, то есть в состоянии гипоксии. Затем биологии создали биосенсор на лактат, основываясь на природной схеме. Белок-репрессор в такой системе мешает экспрессии целевого гена ровно до тех пор, пока не свяжется с лактатом. И наконец, сенсор на уровень кислотности ученые создали, опираясь на протеин-активатор экспрессии, который сам по себе активен только в среде с низкими значениями pH.
Взяв эти конструкции за основу, группа синтетических биологов создала библиотеку биосенсоров, чтобы точно настроить чувствительность и точность устройств. Например, исследователи меняли число копий вектора с конструкциями, которое одновременно может присутствовать в клетке, и добились активации сенсора на кислотность при физиологически возможных значениях pH. Также биологи выбрали варианты сенсоров, активация которых происходила при физиологических концентрациях кислорода и лактатов в разных тканях, например, в желудочно-кишечном тракте или твердых опухолях.
Сначала исследователи проверили, насколько им удастся контролировать деление клеток при помощи созданных биосенсоров. Для этого они поставили необходимые для жизни бактерий ген под управление промотеров-биосенсоров. Выбранный ген требуется для образования в клетках аминокислот лизина, треонина и метионина, и если он отключен, клетки могут расти только в присутствии диаминопимелиновой кислоты. Это соединение бактерии также не могут синтезировать самостоятельно, что делает его идеальным инструментом для сдерживания роста клеток. Чтобы оценить влияние таких изменений, ученые измерили рост бактерий в разных условиях, от неблагоприятных (нормальная концентрация кислорода, 0 милимоль лактата или нейтральная среда) до активирующих биосенсоры (0 процентов кислорода, 10 милимоль лактата или pH 6). Исследователей интересовало, сколько бактерий все же смогут вырасти в условиях, при которых сенсоры не должны позволять клеткам делиться. Доля «убежавших» бактерий составила 10-4, 10-3 и 10-2 для клеток с биосенсорами на гипоксию, содержание лактата и кислотность среды, соответственно.
Далее биологи предложили комбинировать сенсоры: значение одного параметра, например, концентрации кислорода, может быть одинаковым в двух разных органах, тогда как сочетание параметров позволяет более специфично настроить бактерии. Ученые сформировали логические операторы И из уже построенных схем. Биосенсоры на два параметра позволили значительно снизить (на два порядка) количество бактерий, которые смогли вырасти в неподходящей по замыслу авторов условиях.
Затем исследователи испытали систему, высаживая бактерии в культуры, полученные из различных органов животных, например, из лимфатических узлов, молочных желез, кишечника, а также образцов разных типов опухолей легких. Флуоресцентный сигнал, как и ожидалось, усиливался с повышением естественной концентрации лактата в тканях или усилением кислотности среды.
Авторы работы решили также проверить, может ли система помочь локализовать бактерии в определенном участке желудочно-кишечного тракта. Концентрация кислорода и уровень кислотности постепенно снижается от начала к концу желудочно-кишечного тракта, то есть для выполнения задачи достаточно двух биосенсоров. Ученые использовали пробиотический штамм кишечной палочки, который уже используется в практике для лечения людей с расстройством кишечного тракта. Способность биосенсоров сдержать размножение бактерий в кишечнике проверили и в искусственно воссозданных условиях, и на животных. В пробирках со средой, имитирующую различные отделы кишечника, удалось добиться специфичности роста, но на животных моделях отдельные сенсоры на кислотность и на гипоксию оказались не так успешны.
Комбинированные биосенсоры авторы работы проверили на опухолях. В этих экспериментах внимание ученых привлекла бактерия Salmonella enterica serovar Typhimurium, которая известна своим усиленным ростом в опухолевых тканях. Этот вид уже изучают как инструмент для терапии онкологических заболеваний, однако S. Typhimurium также порой выживает в печени и селезенке. Теоретически, сделать природные предпочтения бактерии более специфичными как раз можно при помощи разрабатываемой системы. Например, настроить клетки расти в условиях гипоксии, повышенных концентрациях лактата и кислотности. Бактерии с отдельными и с комбинированным биосенсором выращивали в трехмерной опухолевой культуре. Ожидаемо, в центре сфероидов был зафиксировано высокое содержание бактерий, которое постепенно снижалось к его поверхности. Кроме того, в мышиных моделях, S. Typhimurium, которые реагировали сразу на два параметра среды, на четыре-пять порядков хуже колонизировали печень и селезенку, чем бактерии без биосенсоров, а также значительно меньше, чем бактерии только с одним биосенсором.
Ученые не впервые рассматривают бактерии как инструмент для диагностики или терапии. Например, ранее удалось заставить кишечную палочку прицельно доставлять лекарственные средства в ткани мышей. В другом исследовании, авторы также воспользовались способностью бактерии Magnetococcus marinus чувствовать магнитное поле, чтобы доставить противоопухолевые препараты в злокачественные новообразования.
Автор: Вера Сысоева