В рамках синтетической биологии проводятся эксперименты с системой MultiFate, моделирующей создание из генетически идентичных клеток множества различных типов, имеющихся в организмах той же сложности, что и наши.

Согласно подсчётам большинства специалистов, человеческое тело содержит более 200 типов клеток, причём все они — потомки одной оплодотворённой яйцеклетки. Длинные и тонкие клетки кожи, ветвящиеся, образующие узлы нейроны, пухлые жировые клетки, чрезвычайно чувствительные палочки и колбочки глаз — всё это продукты длительного процесса развития, в ходе которого формы клеток менялись до неузнаваемости. Однако, за редким исключением, у всех этих клеток те же гены, что и у оплодотворённой яйцеклетки. Единственное, что меняется от клетки к клетке, — это то, какие гены активны.
Но как генетически идентичные клетки превращаются в разные идентичности? Что происходит на молекулярном уровне, когда стволовые клетки становятся кожными, и почему последние остаются таковыми, а не превращаются в мышечные или жировые?
Эти вопросы имеют отношение к развитию любого сложного организма, будь то горчица, многоножка или голубой кит, поэтому наука упорно стремится ответить на них. Создававшимся ранее генетическим моделям всегда не хватало важных аспектов того, что наблюдается в природе, и не в последнюю очередь — простоты, позволяющей так расширять масштаб, чтобы появлялась возможность определять множество клеточных судеб.
И вот группа биологов Калифорнийского технологического института (California Institute of Technology) с опытом физических исследований сообщила в журнале Science, что разработала простую генную сеть, которая способна выводить на уровень удивительно сложных форм поведения, напоминающих естественные. Возможно, это — прорыв в осмыслении того, как природа приказывает клеткам дифференцироваться.
Введя в клетки небольшое количество сконструированных генов и применив правильные химические сигналы, исследователи смогли задать клеткам семь разных стабильных состояний, каждое из которых можно различить под микроскопом по особому свечению. Полученные клетки проявляли ключевые свойства дифференцированных клеток; например, они стабильно сохраняли свою принадлежность к одному типу клеток, но, кроме того, демонстрировали наличие «памяти» о своём прежнем поведении, которая влияла на их реакцию на новые условия жизни.
Математические модели говорят о том, что с помощью всего лишь нескольких дополнительных генов можно задать сотни клеточных идентичностей, а этого более чем достаточно для заполнения тканей сложных организмов. Это новое знание открывает дверь для экспериментов, способных приблизить нас к пониманию того, как много веков назад была построена система, которая строит людей.
Пределы взаимного подавления
Биологи-эволюционисты, изучая естественные клетки, выявили множество переломных моментов и химических сигналов, которые побуждают клетки следовать тому или иному пути развития. Но, как объяснил Майкл Эловиц (Michael Elowitz), профессор биологии и биоинженерии Калифорнийского технологического института и один из авторов вышеупомянутой статьи, в синтетической биологии часто используется другой подход: чтобы выяснить, что требуется системе управления судьбами клеток, практически с нуля создаётся соответствующая модель.
Важный шаг в этом направлении более 20 лет назад сделали исследователи из Бостонского университета (Boston University) во главе с Джеймсом Коллинзом (James Collins). В статье, опубликованной в журнале Nature, они описали искусственную схему управления клетками, внедрённую в бактерии Escherichia coli. Эта схема позволяет задавать клеткам одно из двух предусмотренных для них состояний. Сконструированные клетки светились зелёным до тех пор, пока был отключён ген, подавляющий выработку флуоресцентного зелёного пигмента. Однако при добавлении в раствор с клеточной культурой особого химического вещества активировался ген-репрессор — и это свечение исчезало. Определённая доза другого химического вещества обращала процесс вспять, приводя в действие второй репрессор, возвращающий зелёное свечение.
Два задаваемых состояния были стабильными: до добавления химического вещества, вызывающего изменение, клетка оставалась либо светящейся, либо тёмной. Эта стабильность напоминает поведение клеток в природе: здесь их судьбы постоянно определяются химическими командами, которые они получают во время развития. Ключевой особенностью описанной системы управления является то, что два репрессора подавляют друг друга — при действии одного из них другой бездействует.
Этот вид взаимного подавления занимает центральное место в большинстве систем управления клетками, разработанных биологами после эксперимента Коллинза. Элегантным примером является система, разработанная Сяо Ваном (Xiao Wang), адъюнкт-профессором биомедицинской инженерии Университета штата Аризона (Arizona State University), и его коллегами. Она была описана ими в статье 2017 года. Используя два взаимно подавляющих фактора транскрипции и два самоактивирующихся гена, они создали систему, способную приводить Escherichia coli в четыре разных состояния.
Однако при расширении масштабов системы взаимное подавление может оказаться сложным. Вы можете генерировать дополнительные стабильные состояния, добавляя гены, но каждый ген должен иметь способность ингибировать все остальные. Этот подход выглядел громоздким даже при проведении амбициозных экспериментов в рамках синтетической биологии, и природа явно не могла полагаться на такую неустойчивую систему, чтобы направлять развитие клеток в организмах.
Гибкая, адаптируемая и надёжная система
Когда Эловиц и аспирант в его лаборатории Жунхуэй Чжу (Ronghui Zhu) обсуждали эту проблему, они задались вопросом, есть ли более простой способ расширения масштабов. «Фундаментальным свойством естественной системы является то, что она масштабируема. Это было, я думаю, ключевым прозрением, — сказал Эловиц. — Вам нужен дизайн, который [не требует], чтобы каждый раз, когда вы что-то добавляете, приходилось перестраивать всё, что уже сделано».
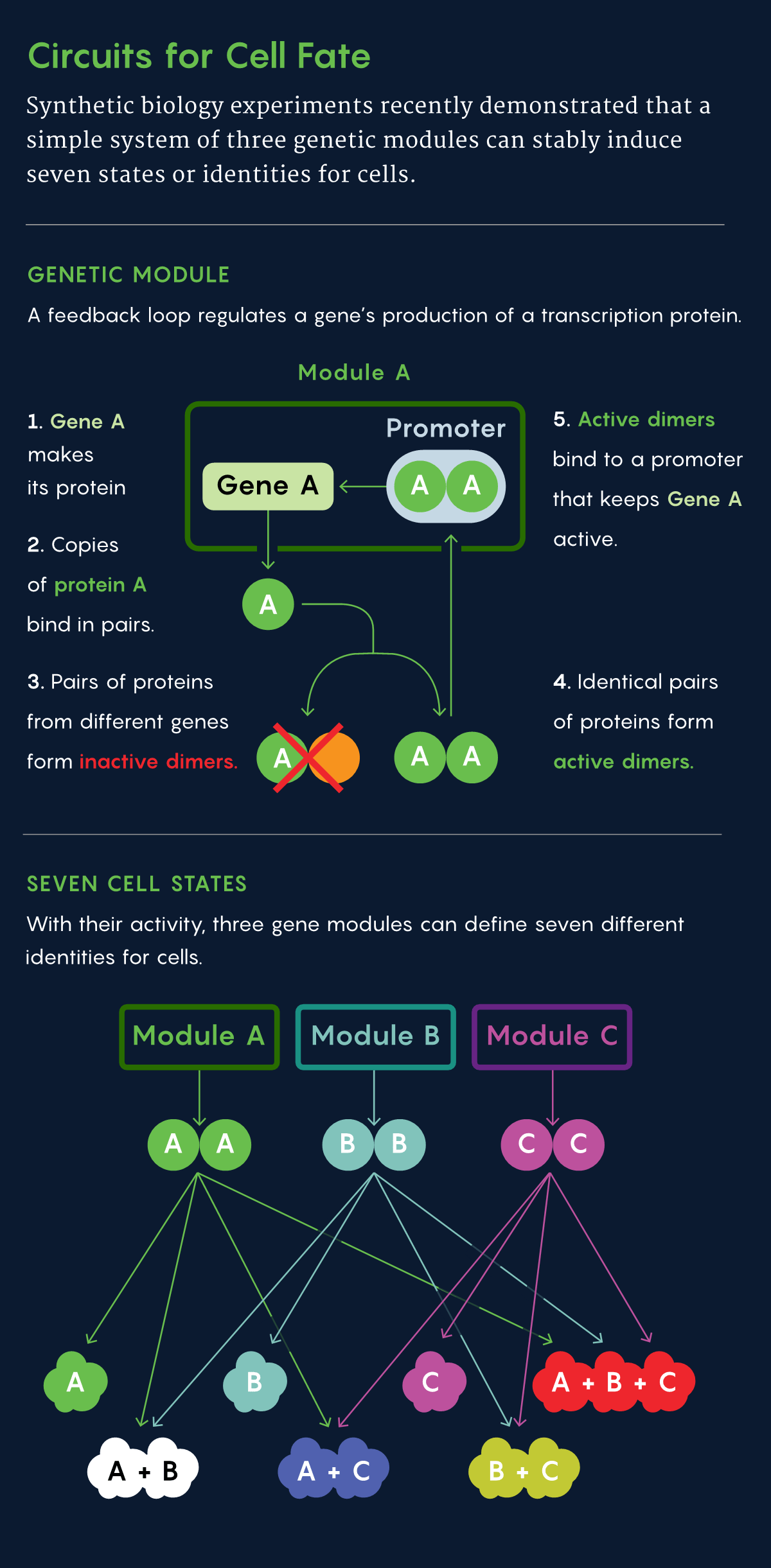
Пытаясь найти решение проблемы в природе, исследователи отметили, что белки-факторы транскрипции связываются друг с другом парами, или димерами. Фактор транскрипции иногда связывается с копией самого себя, а иногда с совершенно другим фактором. То, с чем связан фактор, может радикально изменить его способности, позволяя ему активировать новые гены или полностью отключая его. Перестановки пар образуют сеть возможных клеточных состояний.
С учётом этих знаний Эловиц и Чжу разработали математическую модель системы, в которой пары факторов транскрипции, ингибирующих и стимулирующих друг друга, могут управлять состояниями клеток. В их новой системе каждый ген продуцирует белок-фактор транскрипции; эти белки связываются друг с другом в виде димеров, чтобы оказывать определённое действие. Если связываются две копии одного и того же фактора, образующийся «гомодимер» стимулирует дальнейшую выработку геном белка — петля положительной обратной связи. Однако если данный фактор связывается с другим фактором с образованием «гетеродимера», фактор транскрипции неактивен.
Замечательным свойством этого устройства является то, что как только активность или неактивность гена фактора транскрипции установлена, он стремится оставаться в этом состоянии. Точные количества различных комбинаций димеров могут быть точно настроены для получения любого желаемого паттерна генной активности. Значительные изменения окружающей среды, влияющие на стабильность факторов транскрипции, могут перевести клетку из одного состояния в другое, но случайные небольшие изменения игнорируются. Это делает систему управления гибкой, адаптируемой и надёжной.
Много позже Эловиц, Чжу и их команда решили посмотреть, смогут ли они на практике выстроить такую же систему в клетках млекопитающих, не следуя примеру исследователей других лабораторий, чьи системы управления работали в основном с бактериями Escherichia coli. Опираясь на набор компонентов факторов транскрипции, собранный их коллегами, калифорнийская команда разработала два, которые активны как гомодимеры, но неактивны как гетеродимеры. Система управления, построенная на использовании этих факторов, способна переводить клетки в три различных состояния: первое, в котором активен только первый ген, второе, в котором активен только второй ген, и третье, в котором активны оба гена. Какое состояние преобладает, должно зависеть от стабильности факторных белков и от степени вероятности их связывания друг с другом. «Этот дизайн предоставляет вам комбинаторное управление, а также позволяет одному состоянию подавлять другие», — отметил Чжу.
Конечно, моделировать — это одно, а заставить что-то работать в живой клетке — совсем другое. «Если у вас огромный опыт математического моделирования в биологии, вы всегда помните, что во многих случаях модели — очень грубое приближение к тому, что действительно происходит, и поэтому, используя их, очень часто бывает сложно прогнозировать действительность», — говорит Эловиц. Когда Чжу ввёл гены для первоначального тестирования в клетки хомяка, и клетки послушно образовали живописный зелёно-красно-жёлтый узор, команда была удивлена. Система, которую исследователи назвали «MultiFate», по всей видимости, работала.
Чтобы посмотреть, будет ли её масштаб расширяться в полном соответствии с математическими расчётами, учёные добавили третий фактор транскрипции, с которым число состояний должно было вырасти до семи. Клетки услужливо развернули калейдоскоп из семи оттенков. Эти состояния при отсутствии сильного возмущающего воздействия сохранялись более месяца, воспроизводя стабильность естественной системы.
Исследователи также наблюдали за реакцией клеток на изменения. Изменяя концентрацию химического вещества в окружающей клетки среде, они дестабилизировали белки-факторы транскрипции; как и ожидалось, это заставляло клетки переходить из одного состояния в другое. Был, однако, и интригующий момент: реакции сконструированных клеток частично определяла их история. Они меняли свои состояния, когда концентрация химического агента понижалась, но когда она вновь повышалась, простого возвращения к прежнему состоянию не было.
Эта поведенческая асимметрия имеет параллель в природе, где клетки, например переживающие период дефицита, могут оставаться в постоянном состоянии накопления энергии. Перестройка окружающей среды не стирает имеющийся у клеток опыт.
Прогулка по клеточному ландшафту
«Это чрезвычайно разумно, — считает Ахмад Халил (Ahmad Khalil), профессор Бостонского университета (Boston University), который является соавтором комментария к статье Эловица и Чжу для журнала Science. — [Это] демонстрирует, как можно идти по этому ландшафту — менять этот ландшафт — различных состояний, просто увеличивая или уменьшая белковую стабильность».
Это фундаментальное достижение, ибо, что бы ни представлял собой тот процесс, который сегодня привёл к бурлящей сложности огромных многоклеточных организмов, он должен был начаться весьма просто и иметь какую-то базовую и изменчивую основу, такую как стабильность белка. Система Эловица и Чжу наводит на мысль, что этих или подобных принципов достаточно для создания всего грандиозного разнообразия природы.
Достижение калифорнийских учёных, отмечает Ван, разработавший систему Escherichia coli с четырьмя стабильными состояниями, говорит о том, что эти исследователи использовали при моделировании нелинейную динамику — раздел математики, имеющий дело с системами, которые часто выдают сложные, неожиданные результаты. «Вся сеть генной регуляции является нелинейной», — утверждает он. Нелинейность нередко ведёт к хаосу, но в биосфере это, как правило, не так. «Значит, здесь есть что-то ещё, какие-то глубокие принципы и правила, которые делают эту штуку такой сложной, но в то же время такой надёжной».
«Теоретически, если у вас есть главная сеть с восьмью факторами транскрипции, у вас есть основной механизм, позволяющий формировать человеческое тело», — добавил Ван. Действительно, как отметили Эловиц и Чжу в своей статье, посвящённой системе MultiFate, всего 11 факторов транскрипции, в принципе, позволяют получить более 1000 устойчивых состояний.
«На бумаге масштабируемость превосходная, — говорит Ван. — Но когда вы расширяете масштаб, нужно быть осторожным. В биологии так много неизвестного. Мы можем увидеть то, чего не ожидаем».
Халил предполагает, что в будущем исследователи смогут использовать систему MultiFate для управления не только цветом клетки, но и реальными аспектами её роста и изменения. Возможно, клетки, вводимые в тело пациента, станут сконструировать так, чтобы они реагировали на окружающую среду, следуя желаемым путям развития. Например, почувствовав рак, они будут развиваться диагностически или терапевтически полезным способом. «Это очень крутая идея», — сказал он.
Данная система, убеждён Эловиц, открывает дорогу к пониманию кишащей странностями биологии как чего-то гораздо более сложного, чем машина Руба Голдберга (Rube Goldberg). Причудливые приспособления этого художника, выполняющие простые задачи максимально сложным образом, были «идеальным воплощением неразвитого дизайна», сказал он, — чего-то такого, что делает только то, для чего оно предназначено, и ничего больше.
«Естественные системы… могут выглядеть такими поверхностными, потому что мы не до конца понимаем, что происходит, — отмечает он. — Как только поймём, как правильно на всё это смотреть, мы, надеюсь, сможем оценить увиденное как простой дизайн».
Автор: Вероник Гринвуд (Veronique Greenwood), Перевод: Александр Горлов