Новозеландские, австралийские, американские и китайские исследователи сообщили об успехе первой фазы клинических испытаний CAR-T-лимфоцитов третьего поколения с внутриклеточными доменами CD28 и TLR2 для лечения B-клеточной лимфомы.
По эффективности они не уступали противораковым клеткам предыдущих поколений, демонстрируя при этом значительно меньшую токсичность. Отчет о работе авторы представили на Ежегодном слете Американского гематологического общества ASH 2023 в Сан-Диего, также он опубликован в журнале Blood.
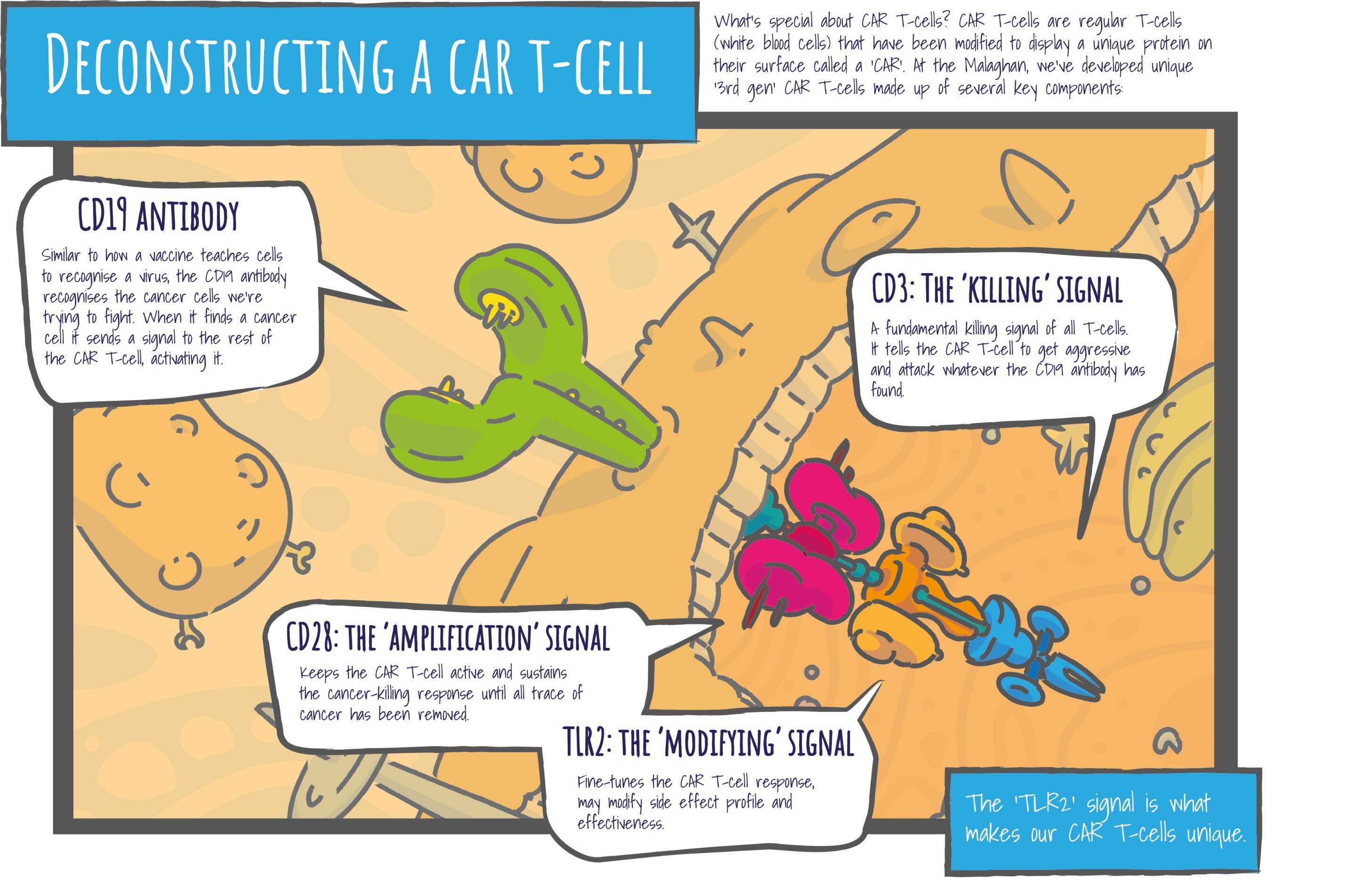
Технологи изготовления терапевтических CAR-T-лимфоцитов состоит в том, что у обычных T-лимфоцитов удаляют их основной распознающий антигены рецептор (TCR) и заменяют его химерным антигенным рецептором (CAR) — синтетическим конструктом из антиген-распознающего фрагмента заданного антитела и внутриклеточных доменов (подробно об этом рассказано в материале «Химера против рака»). Подобные клетки первого поколения содержат только домен активации CD3ζ, второго — также ко-стимулирующий домен CD28 или 4-1BB (иногда оба сразу), третьего — дополнительные ко-стимулирующие домены. В случае анти-CD19 CAR-T-лимфоцитов, предназначенных для лечения B-клеточных опухолей, CD28 показывает более высокую эффективность, чем 4-1BB, но значительно чаще вызывает тяжелые побочные эффекты — синдром нейротоксичности, связанный с эффекторными иммунными клетками (ICANS), и синдром выброса цитокинов (CRS, «цитокиновый шторм»). При этом доклинические испытания показали, что уменьшить токсичность при сохранении эффективности можно, поместив между CD3ζ и CD28 толл-подобный рецептор 2 (TLR2, CD282).
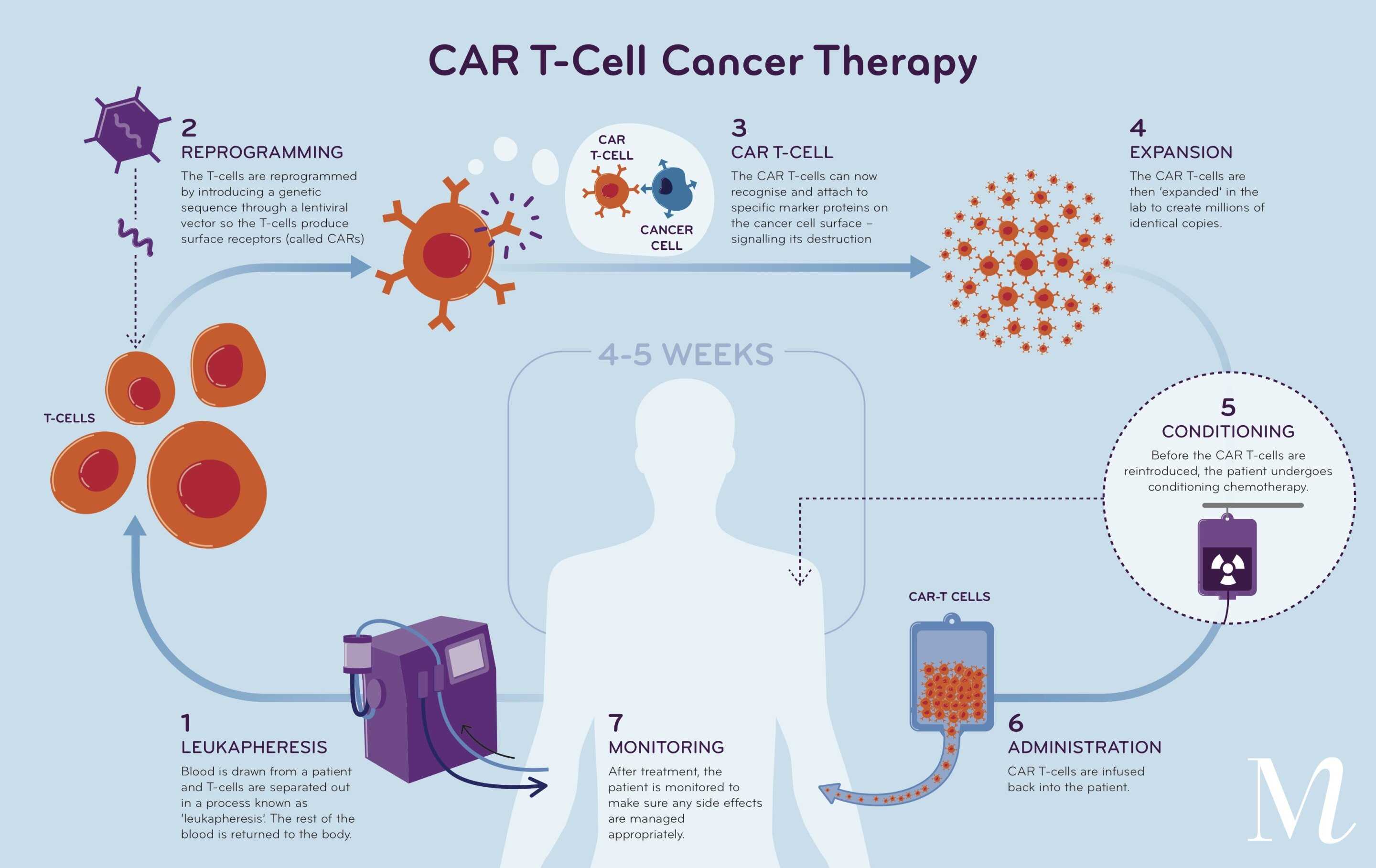
Роберт Уайнков (Robert Weinkove) из Медицинского исследовательского института имени Малагана с коллегами из Новой Зеландии, Австралии, США и Китая сообщили о результатах проведенных ими клинических испытаний первой фазы ENABLE с увеличением доз препарата WZTL-002, представляющего собой 1928T2z CAR-T-лимфоциты на основе собственных клеток пациентов. Его вводили после лимфодеплеции внутривенно в дозах от 5 × 104 до 1 × 106 жизнеспособных CAR-T на килограмм массы тела 21 пациенту (возраст 23–70, в среднем 57 лет; 48 процентов — женщины). Все они страдали рецидивирующими или рефрактерными к терапии B-клеточными неходжкинскими лимфомами и прошли до этого (в медиане) четыре линии терапии. При этом функции внутренних органов у них были удовлетворительными, нервная система заболеванием не затронута.
Эффекты оценивали на третий месяц от начала терапии. Фармакокинетику анализировали методом капельной ПЦР на трансгены CAR в мононуклеарных клетках крови, ответ оценивали с помощью ПЭТ/КТ, градацию побочных явлений проводили по CTCAE 5.0, кроме CRS и ICANS — по критериям ASTCT.
При всех дозировках WZTL-002 CAR-T-лимфоциты размножались в организме и производили эффект; у 11 пациентов (52 процента) на третий месяц наблюдался полный метаболический ответ. У 12 участников, получивших дозы 0,5–1,0 × 106 CAR-T на килограмм массы тела, их медианный пиковый уровень (Cmax) составил 93950 копий трансгена на микрограмм геномной ДНК, к 90-му дню CAR-T-лимфоциты сохранялись у девяти из 11 обследованных на них пациентов.
Побочные явления третьей и выше степени, которые наблюдались у 10 и более процентов участников включали: нейтропению (95 процентов), лимфопению (57 процентов), гипогаммглобулинемию (57 процентов), анемию (43 процента), фебрильную нейтропению (43 процента), тромбоцитопению (24 процента) и боль в области опухоли (19 процентов). CRS первой-второй степени развился у 13 пациентов (62 процента); шести назначили тоцилизумаб и трем — дексаметазон. CRS третьей и выше степени и ICANS любой степени не было ни у одного из участников. На 21-й день были выявлены два случая цитопении четвертой степени, лимитирующих дозу препарата, оба разрешились до второй степени к 90-му дню.
Таким образом, применение анти-CD19 CAR-T-лимфоцитов с комбинацией ко-стимулирующих доменов CD28 и TLR2 при рецидивирующих и рефрактерных B-клеточных неходжкинских лимфомах позволяет избежать тяжелых токсических реакций при сохранении или даже повышении эффективности терапии, заключают авторы работы. Рекомендованную дозировку препарата для второй фазы испытаний установили на уровне 0,5–1,0 × 106 CAR-T на килограмм массы тела.
Автор: Олег Лищук